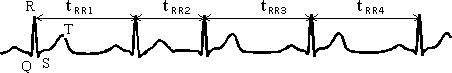
Сердечно-сосудистая система выполняет важную транспортную функцию в организме, необходимую для его нормальной жизнедеятельности.
В медицине критических состояний диагностика функционирования этой системы занимает одно из главных мест, так как деятельность сердечно-сосудистой системы во многом определяет эффективность протекания процессов метаболизма, переноса кислорода и углекислого газа, терморегуляции.
Оценка деятельности сердечно-сосудистой системы при анестезиологическом мониторинге осуществляется путем регистрации механических, акустических и биоэлектрических проявлений сердечной деятельности, наиболее доступных для регистрации во время наркоза. Среди показателей центральной и периферической гемодинамики наибольшую ценность представляют параметры сердечного ритма, артериального и венозного давления крови, сердечного выброса.
Широко распространенными методами контроля сердечной деятельности являются слежение за величиной ЧСС, артериального давления крови, наблюдение ЭКГ в одном или нескольких отведениях с автоматическим обнаружением нарушений ритма. Использование данных методов контроля в клиническом мониторинге характеризуется простотой процедур регистрации биологических сигналов и интерпретации показаний. Более сложные и громоздкие методы, используемые при функциональных исследованиях сердечно-сосудистой системы, такие как радионуклеидная ангиография, ядерный магнитный резонанс, чреспищеводная эхокардиография, допплеровские системы измерения потока крови используются по специальным показаниям. Эти методы исследования чаще всего интересуют хирургов и не связаны непосредственно с работой анестезиолога.
Выбор средств контроля показателей сердечно-сосудистой системы для клинического мониторинга зависит от многих факторов. Так, например, при анестезиологическом контроле наиболее важную роль играет вид операции, пластичность сердечно-сосудистой системы пациента, обоснованность риска использования инвазивных методик, стоимость мониторной техники. В то же время главным фактором выбора средств анестезиологического мониторинга является необходимость и достаточность получаемой информации для оптимального управления состоянием пациента и обеспечения безопасности наркоза.
Контроль параметров сердечного ритма
Мониторинг частоты сердечных сокращений
Наиболее простым методом оценки параметров сердечного ритма является определение частоты сердечных сокращений. Этот показатель позволяет объективно судить об уровне функционирования сердечно-сосудистой системы пациента. При анестезиологическом мониторинге изменения ЧСС во время наркоза отражают реакцию организма на хирургическое вмешательство. Оценка ЧСС в простейшем случае может производиться путем пальпации колебаний артериальной сосудистой стенки.
Мониторные приборы, используемые в анестезиологической практике осуществляют непрерывное измерение и цифровую индикацию ЧСС. Эти данные определяются по результатам оценки временных параметров физиологических процессов, происходящих в сердечно-сосудистой системе.
Для определения ЧСС необходимо выделить артериальную пульсацию кровотока, а затем измерить частоту следования пульсовых колебаний.
При неинвазивных методах измерения артериального давления крови ЧСС оценивается по колебаниям давления в окклюзионной манжетке. В случае прямых измерений давления в магистральных сосудах или легочной артерии анализируются пульсовые кривые, регистрируемые на выходе внутрисосудистого датчика давления крови.
В пульсоксиметрах определение ЧСС основано на анализе фотоплетизмограммы участка тканей с артериальным пульсом, чаще всего для этой цели используется кончик пальца руки или мочка уха.
При реографических исследованиях параметров гемодинамики для оценки пульса анализируется электрический сигнал, соответствующий изменению электрического сопротивления участка тканей с пульсирующим сосудом.
Артериальная пульсация может быть зарегистрирована по эффекту Допплера от движущегося потока крови с использованием ультразвуковой или микроволновой техники.
Для определения ЧСС часто используется электрокардиографический канал мониторов, в котором выделяются QRS- комплексы ЭКГ и обрабатываются значения длительностей R-R интервалов.
Определение ЧСС основано на измерении длительности периодов следования пульсовых колебаний (в случае регистрации ЭКГ - QRS- комплексов), представляющих собой межпульсовые ( R-R временные интервалы) - кардиоинтервалы (КИ) / 16 /. После усреднения определенного количества (выборки) полученных значений длительности КИ, ЧСС определяют по формуле:
ЧСС [ уд/мин] = 60 / Tср,
где Tср = ( T1ки+T2ки+...Tnки) / n,
здесь Tiки [ сек ] - значение i-того КИ, n - количество КИ в выборке.
Процедуры усреднения и вычисления значений ЧСС осуществляются в устройстве обработки прибора, построенного, чаще всего, на однокристальной ЭВМ.
В анестезиологических мониторах используется “быстрое” усреднение периодов пульсовых колебаний (например, определяется среднее по 8 КИ, т.е. обьем выборки n = 8). Это дает возможность отслеживать кратковременные эпизоды изменения ЧСС, возникающие, например, при интубации трахеи, и быстро реагировать на эти измерения.
Индикация показаний ЧСС осуществляется методом “скользящей” выборки, т.е. после усреднения КИ, находящихся в выборке, вычисления ЧСС и индикации полученного значения ”окно” выборки сдвигается на один КИ, затем вновь происходит усреднение, вычисление и индикация и т. д.. Таким образом, цифровой индикатор ЧСС может изменять свои показания с каждым ударом сердца, реагируя на изменения длительности КИ, находящихся в “окне” выборки.
ЭКГ дает информацию о сокращениях сердечной мышцы даже тогда, когда
уровень пульсации сосуда снижается ниже порога регистрации и падает артериальное
давление, что делает информацию о ЧСС, полученную по R-R интервалам, особенно
ценной. В то же время, при использовании ЭКГ для определения ЧСС необходимо
контролировать форму электрокардиосигнала, так как при высокой Т-волне
возможно ошибочное удвоение значений ЧСС. Это требование нетрудно выполнить,
так как ЭКГ канал мониторов имеет графический дисплей для слежения за формой
ЭКГ в реальном масштабе времени.
Мониторинг вегетативных показателей регуляции ритма сердца
Ритм сердечных сокращений является наиболее доступным для регистрации физиологическим параметром, отражающим процессы вегетативной регуляции в сердечно-сосудистой системе и организме в целом. Динамические характеристики ритма сердца позволяют оценить выраженность сдвигов симпатической и парасимпатической активности ВНС при изменении состояния пациента.
Анализ вегетативной регуляции по наблюдению за изменениями показателей ритма сердца позволяет выявить картину, характерную для диагностики целого ряда состояний в различных областях медицины.
Так, в медицине критических состояний при проведении общей анестезии мониторинг показателей ритма сердца дает возможность проследить за динамикой реакции ВНС на операционную травму и наркоз.
При анализе адаптационного синдрома активность ВНС, определяемая по отношению к своему тоническому уровню, может быть соотнесена с мерой адаптационных реакций организма, что дает возможность контроля выраженности стресса на всех его стадиях / 17 /. Поскольку ритм сердца находится под контролем звеньев всех уровней управления функциями организма, то его анализ дает достоверную оценку адаптации системы кровообращения и организма в целом к действию стрессорных факторов.
Следует отметить, что контроль величины ЧСС не всегда в полной мере отражает изменение активности ВНС. Одному и тому же значению ЧСС могут соответствовать неодинаковые комбинации активности звеньев ВНС, обеспечивающие вегетативный гомеостаз. Так, например, снижение тонуса парасимпатического отдела ВНС может сопровождаться уменьшением активности симпатического отдела, при этом средняя ЧСС остается постоянной, не отражая изменение состояния вегетативной регуляции.
Активность вегетативной регуляции проявляется в изменении показателей хронотропной структуры сердечного ритма. Математические методы анализа обнаруживают вариабельность сердечного ритма - изменчивость значений длительностей КИ относительно друг друга. Другими словами вариабельность сердечного ритма отражает выраженность колебаний ЧСС по отношению к ее среднему уровню.
В покое, когда превалирует тонус парасимпатического отдела ВНС, вариабельность сердечного ритма обусловлена, большей частью, вагусными влияниями. При активации симпатического отдела ВНС, происходящей во время стресса, показатели вариабельности сердечного ритма падают.
Изменение вариабельности связано с интенсивностью процессов активации отделов ВНС по отношению к сердечно-сосудистой системе и позволяет судить о степени адаптационной реакции организма на то или иное воздействие в целом.
Для оценки вариабельности сердечного ритма необходимо зарегистрировать последовательный ряд КИ , измерить их длительности и провести математическую обработку динамического ряда полученных значений.
Наибольшее распространение в клинической практике получили методы временного (статистического) и частотного (спектрального) анализа вариабельности сердечного ритма.
Согласно рекомедациям Европейского общества кардиологиии и Североамериканского общества кардиостимуляции и электрофизиологии для оценки вариабельности сердечного ритма могут быть использованы такие статистические оценки ряда КИ как среднеквадратическое отклонение длительности КИ в выборке.
Спектральный анализ динамического ряда КИ рекомендуется проводить в 3-х диапазонах частот :? 0,04 Гц (VLF), (0,04...0,15) Гц (LF), 0,15...0,4 Гц (HF), которые обладают различной диагностической ценностью / 18 /.
К методам временного анализа сердечного ритма относится вариационная пульсометрия, используемая в различных областях медицины с целью диагностики состояния человека / 17,19,20 /. Методика основана на применении статистических оценок выборки динамического ряда значений длительностей КИ. Использование в качестве КИ - R-R интервалов ЭКГ, зарегистрированных в одном из стандартных отведений, позволяет наиболее точно измерить значения длительностей КИ - tRR (рис.4).
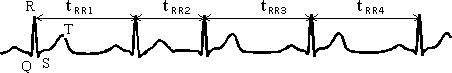
tRR - длительность КИ
Рисунок 4 - Определение длительности КИ по электрокардиограмме
Статистический анализ значений длительностей КИ позволяет наглядно представить закон распределения случайного процесса, которым является ритм сердца, в виде ступенчатой функции - гистограммы, которая может отображаться на дисплее монитора, и описать его набором вычисляемых статистических параметров и диагностических показателей, отражающих активность ВНС.
Для статистической оценки выбирается определенное число значений следующих друг за другом КИ, образующих выборку. Объем выборки N обычно устанавливается в диапазоне 50...250. Однако, как показывают исследования, при выборе N < 100 падает статистическая достоверность результатов оценки / 21 /.
Построение гистограммы производится путем сортировки выборки КИ по их длительности. Для этого весь диапазон длительностей КИ разбивается на временные поддиапазоны одинаковой величины tп. По мере регистрации ЭКГ и измерения длительности КИ подсчитываются количества КИ, попадающие в каждый поддиапазон. Для построения гистограммы в виде ступенчатой функции по горизонтальной оси откладывается длительность КИ, по вертикальной - их количество в соответствующем поддиапазоне).
Для здоровых людей в состоянии покоя регистрируется нормальная гистограмма, близкая по виду к симметричной кривой Гаусса (рис. 5).
Распределение длительностей КИ (гистограмму) можно охарактеризовать набором статистических оценок:
Мо - мода распределения - значение длительности КИ, наиболее часто встречающееся в выборке КИ; в качестве Мо часто принимается начальное значение поддиапазона длительности, в котором отмечено наибольшее число КИ, выражается в секундах.
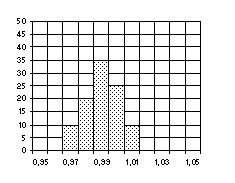
Рисунок 5 - Гистограмма распределения КИ
АМо - амплитуда моды распределения - число КИ, соответствующих поддиапазону моды, выражается в % к объему выборки.
DХ - вариационный размах - разность между максимальным и минимальным значением длительности КИ в выборке, выражается в секундах.
Ассиметричная форма гистограммы указывает на нарушение стационарности процесса регуляции ритма сердца и наблюдается при переходных состояниях. Многовершинная (многомодовая) гистограмма может быть обусловлена наличием несинусового ритма ( мерцательная аритмия, экстрасистолия ), а также артфактами, возникающими при регистрации ЭКГ. Для описания отклонения формы гистограммы от нормального закона распределения используются статистические оценки - показатель ассиметрии ( As ) и эксцесса ( Ех ).
В мониторных приборах для слежения за текущим состоянием пациента используется автоматизированная обработка данных по методу скользящей выборки.
В первом такте анализа распределения КИ для построения гистограммы, вычисления статистических оценок и диагностических показателей берется выборка КИ, установленного объема, начиная с 1-го по N-ый зарегистрированный КИ.
Например, при объеме выборки N = 100, в первом такте анализа для обработки берутся значения длительностей КИ с порядковыми номерами с 1-го по 100-ый.
Результаты анализа в первом такте работы - графическое изображение гистограммы и значения вычисленных параметров и показателей отображаются на дисплее прибора.
В следующем такте работы происходит сдвиг "окна" выборки, т.е. для обработки берутся значения КИ с порядковыми номерами на единицу больше (В приведенном выше примере - со 2-го по 101-й). После вычислений данные на экране дисплея обновляются: отображаются результаты анализа полученные во втором такте работы. В дальнейших тактах работы происходит последующий сдвиг "окна", в результате чего информация на экране обновляется с каждым тактом работы , то есть с каждым ударом сердца.
Быстродействие современных вычислителей (микропроцессорных устройств, однокристальных ЭВМ, ПЭВМ) позволяет наблюдать изменения отображаемых показателей ритма сердца на дисплее в реальном времени, что обеспечивает оперативное слежение за динамикой изменения сердечного ритма.
В результате математического анализа ритма сердца методом вариационной
пульсометрии вычисляются приведенные выше статистические оценки распределения
КИ, с помощью которых затем формируются диагностические показатели, характеризующие
активность звеньев вегетативной регуляции.
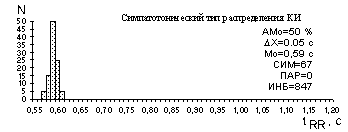
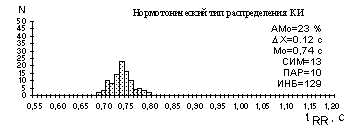
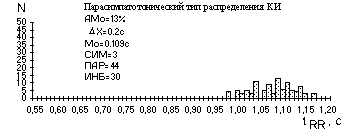
Рисунок 6 - Типы распределения длительностей КИ
Формирование диагностических показателей для оценки выраженности стресса у больных в интраоперационном периоде по результатам вариационной пульсометрии рассмотрено в ряде физиологических и клинических работ / 20,22 - 26 /.
Известно, что изменения показателей ритма сердца при стрессе наступают раньше, чем появляются выраженные биохимические и гормональные сдвиги, так как реакция нервной системы обычно опережает действие гуморальных факторов. Это позволяет путем наблюдения за показателями активности ВНС своевременно корректировать анестезиологическую защиту пациента и предупреждать появление выраженных проявлений стрессовой реакции.
Формирование показателей активности отделов ВНС затруднено без соответствующих инструментальных средств, доступных широкому кругу анестезиологов и реаниматологов, однако появление в последние годы автоматизированных ритмокардиомониторов и компьютерных средств обработки электрокардиосигнала решает эту проблему / 27 - 30 /. При использовании мониторных приборов контроля сердечного ритма оценка состояния пациента может производиться путем непосредственного наблюдения на дисплее прибора гистограммы распределения КИ и интерпретации ее формы, а также путем контроля величин вычисляемых в приборе и индицируемых диагностических показателей / 31 /.
При наблюдении гистограммы распределения КИ можно выделить, по крайней мере, три ее основных типа, качественно и количественно характеризующих три основных состояния регуляторных систем: нормотоническое, симпатотоническое, парасимпатотоническое, которые имеют различные статистические характеристики (рис.6).
По экрану дисплея ритмокардиомонитора можно визуально в реальном масштабе времени оценить тип распределения длительностей КИ и тенденции его изменения.
Для диагностической оценки состояния пациента по структуре гистограмм распределения КИ производится расчет и индикация на экране дисплея таких статистических оценок, как : Мо, Амо, DX или диагностических показателей, характеризующих вариабельность ритма сердца.
К таким диагностическим показателям относится величина среднеквадратического отклонения длительностей КИ в выборке, то есть значение квадратного корня из дисперсии распределения КИ. В этом случае ограничение объема выборки приводит к оценке только “быстрых” изменений вариабельности, поэтому часто для определения влияния медленных волн анализируют выборки длительностью до нескольких часов.
Р.М. Баевский / 17,21 / предложил ряд диагностических показателей, являющихся производными статистических оценок распределения КИ :
индекс вегетативного равновесия ИВР = АМо/D Х;
вегетативный показатель ритма ВПР = 1/МоD Х;
показатель адекватности процессов регуляции ПАПР = АМ/Мо;
индекс напряжения регуляторных систем ИНБ = АМо/2МоD Х.
Кардиологический стандарт оценки показателей вариабельности сердечного ритма включает вычисление, так называемого, “индекса Святого Георга”, представляющего собой оценку ширины основания треугольника, интерполирующего гистограмму распределения КИ:
TINN= 2N/AMo.
Этот метод оценки вариабельности позволяет исключить при вычислении индекса TINN не связанные с синусовым ритмом сердца КИ, а также артефакты, образующие “нестационарные” участки гистограммы. Следует отметить, что при использовании индексов Р.М.Баевского участки гистограммы, обусловленные артефактами и экстрасистолами могут существенно искажать действительную картину, поэтому в мониторных приборах целесообразно использовать “помехозащищенные” диагностические показатели вариабельности ритма сердца.
К таким показателям, наряду с TINN, относятся показатели, характеризующие баланс регуляции в ВНС - индексы активности симпатического (СИМ) и парасимпатического (ПАР) отделов ВНС.
Индекс активности симпатического отдела ВНС вычисляется по формуле
СИМ = 4 АМо / N20%,
где N2О% ,ед. - число поддиапазонов гистограммы, содержащих количество КИ, превышающих уровень 20% от значения АМо.
Индекс активности парасимпатического отдела ВНС - ПАР характеризует степень отклонения зарегистрированного распределения КИ от нормального закона распределения / 33 /. Чем больше отклонений от нормального распределения, характеризующегося плавным убыванием количества КИ влево и вправо относительно моды распределения, тем сильнее активность вагусного влияния на регуляцию ритма сердца.
ИНБ учитывает отношение между основными показателями ритма сердца и отражает степень централизации процессов регуляции. У хорошо физически тренированных лиц ИНБ = 80...140 (среднесуточные колебания от 68 до 150) при среднесуточном значении 120 / 32 /.
В норме, как правило, имеют место координированные изменения показателей ритма сердца. Так, для симпатикотонии характерно меньшее значение моды (учащение пульса), обычно сопровождаемое увеличением АМо и уменьшением DХ, что приводит к увеличению ИНБ. Усиление парасимпатического тонуса, наоборот, ведет к уменьшению АМо и увеличению Мо и DХ, а ИНБ уменьшается.
Недостатком использования ИНБ для текущей оценки состояния является его нелинейность: интервал изменения ИНБ при парасимпатической активности колеблется от 0 до 100, а при симпатической от 200 до 1000 и более, т.е. количественная оценка изменений активности в разных диапазонах оказывается трудно сопоставимой.
Для наблюдения за балансом регуляции со стороны симпатического и парасимпатического отделов ВНС удобно использовать индексы СИМ и ПАР, имеющие одинаковую шкалу :
менее 15 ед. - слабая активность отдела ВНС,
16-30 ед. - умеренная активность,
более 30 ед. - высокая активность.
Одинаковая размерность показателей позволяет, наблюдая за динамикой взаимного изменения индексов, оценить структуру реакции ВНС на воздействующие факторы.
У взрослого здорового человека в состоянии физического и психического покоя СИМ не превышает 15 ед. Увеличение СИМ свидетельствует о преобладании симпатического звена в регуляции ритма сердца (увеличение АМо и снижение N2О%, обуславливающее уменьшение степеней свободы в регуляции) и росте напряженности состояния организма.
Визуальный контроль гистограммы на экране дисплея позволяет быстро определить преобладающее влияние одного из отделов вегетативной нервной системы в регуляции ритма сердца.
При симпатикотонии ( рис.6 ) гистограмма имеет узкое основание (малая величина вариационного размаха DХ), большую высоту (рост АМо), возрастает величина СИМ, снижается ПАР.
Для преобладающего влияния парасимпатического отдела ВНС характерно: широкое основание (большое значение DХ), малая высота гистограммы (уменьшение АМо), показатель СИМ снижается, возрастает ПАР.
Для структуры гистограмм при симпатикотонии характерно плавное снижение высоты ее элементов с обеих сторон от значения Мо, гистограмма состоит часто из 2-3 элементов.
Для парасимпатикотонии характерны: отсутствие плавного снижения высоты элементов гистограммы слева и справа от Мо, неравномерность, "зазубренность" огибающей гистограммы.
Изменение показателей ритма сердца при хирургическом стрессе происходит под влиянием различных факторов, отражающих индивидуальную реакцию нервной системы больного, исходный фон, заболевание, влияние вводимых лекарств (анестетиков, анальгетиков и др. препаратов), степень кровопотери, инфекцию и т. д. Поэтому полученные сдвиги показателей являются свидетельством неспецифического реагирования организма на самые разнообразные воздействия и не могут быть интерпретированы в отрыве от клинической картины и других методов исследования. Вместе с тем обработка и анализ ритма сердца является весьма тонким и чувствительным методом, достоверность и точность которого в сочетании с высоким быстродействием превышают аналогичные возможности других методов исследования стрессовой реакции.
Несмотря на некоторые особенности изменения регуляции ритма сердца во время операции в зависимости от индивидуального реагирования организма, вида обезболивания и операции выявлена неспецифичность и одинаковая направленность изменения диагностических показателей.
В дооперационном периоде по показателям ритма сердца можно выявлять больных, недостаточно подготовленных к операции, объективно оценить качество премедикации, обратить внимание хирурга и анестезиолога на наиболее "опасных" пациентов с нестабильными показателями активности ВНС, требующих дополнительной индивидуальной подготовки и более внимательного наблюдения в процессе операции.
При вводном наркозе гексеналом или тиопенталом натрия чаще выявляется уменьшение значения моды. тахикардия. уменьшение DХ, АМо и значение СИМ, ИНБ увеличиваются. При вводном наркозе калипсолом обычно отмечается выраженная симпатикотония.
При ларингоскопии и интубации трахеи нередко наблюдаются дискоординированные сдвиги показателей. Значение СИМ превышает нормальную величину, однако DХ увеличивается. Механическое раздражение рефлексогенных зон блуждающего нерва и симпатических окончаний во время интубации трахеи вызывает одновременное возбуждение обоих звеньев ВНС.
В наиболее травматичный момент операции степень выраженности операционного стресса при адекватной анестезии по данным анализа ритма сердца значительно меньше, чем при неадекватном уровне анестезиологической защиты. Как правило, при адекватной анестезии значения DХ больше, абсолютные значения АМо, СИМ, ИНБ меньше, чем при неадекватной анестезии.
Таблица 2 - Ориентировочные величины показателей ритма сердца у взрослых при абдоминальных операциях / 17, 20, 34 / .
| Анестезия | ИНБ | СИМ | ПАР |
| Адекватная | 200 - 1000 | до 30 | до 30 |
| Неадекватная | более1000 | более 30 | более 30 |
При введении деполяризующих миорелаксантов обычно отмечается усиление парасимпатикотонии, что связано с выбросом калия из мышц. При кровопотере обычно отмечается выраженная симпатикотония, которая слабо корригируется введением фармакологических препаратов и требует восполнения ОЦК. Ориентировочные показатели адекватности анестезии приведены в таблице 2.
При одновременном чрезмерном возбуждении обоих отделов ВНС возможна дискоординация сдвигов показателей ( например, уменьшение значения моды и увеличение DХ ). Подобная ситуация должна насторожить врача, так как может свидетельствовать о дезорганизации регуляторных процессов в организме и необходимости обнаружения причины, ее вызвавшей (выраженное раздражение рефлексогенных зон обоих звеньев ВНС при интубации трахеи, раздражение корня брыжейки, инфаркт миокарда и другие состояния, сопровождающиеся чрезмерной афферентацией или истощением защитных компенсаторных реакций организма).
Коррекцию анестезии по мониторингу вегетативных показателей ритма сердца можно осуществить, например, следующим образом. При преобладании симпатикотонии целесообразно вводить анальгетик с парасимпатическим эффектом (например, фентанил). При выраженной парасимпатикотонии, которая часто наблюдается при тракциях брыжейки кишечника, расширении шейки матки и др., лучше вводить анестетик с симпатическим эффектом (калипсол). При появлении признаков возбуждения двух отделов ВНС следует вводить препараты обоих видов.
С помощью оперативного анализа показателей ритма сердца можно осуществлять индивидуальный подбор не только вида, но и дозы требуемого препарата ("титрование эффекта") с учетом конкретной клинической ситуации.
Таким образом, врач, наблюдая изменения показателей ритма сердца, получает информацию, характеризующую процессы управления основными жизненными функциями, использование которой является перспективным методом контроля состояния организма в медицине критических состояний.
Аппаратура автоматизированного анализа ритма сердца
Аппаратура для следящего контроля параметров ритма сердца выполняется в виде отдельных приборов - кардиомониторов или в виде модулей мониторных систем контроля состояния больных.
В кардиомониторах оценка параметров сердечного ритма ведется по результатам регистрации ЭКГ или периферического пульса. Среди отечественных разработок 80-х годов можно привести несколько кардиомониторов различного функционального назначения.
Ритмокардиометр РКМ-01 предназначен для оценки ЧСС по результатам регистрации ЭКГ и измерениям R-R-интервалов, прибор обеспечивает световую и звуковую тревожную сигнализацию при выходе значений измеряемых параметров за установленные границы.
Электрокардиоскоп ЭКСП-03 позволяет вести визуальный контроль электрокардиосигнала; обеспечивает регистрацию ЭКГ во всех отведениях; защищен от импульсов дефибрилятора; имеет фильтр для ослабления мышечных помех.
Ритмокардиовазометр РКВ-01, входит в состав кардиореанимационного комплекса КРК-01, дает возможность синхронного отображение на экране электронно-лучевой трубки ЭКГ и кривой периферического пульса, регистрируемой с помощью отражательного фотоэлектрического датчика, располагаемого на коже в проекции исследуемого сосуда ; измерения ЧСС по периферическому пульсу, а также слежения за величиной дефицита пульса / 35 /.
Современным отечественным микропроцессорным прибором для анализа ритма сердца является ритмокардиоскоп “РКС-02“/ 16 /. Прибор позволяет вести наблюдение ЭКГ, автоматизированную диагностику характера ритма сердца со сменой информации через каждые 1,5 минуты. Диагностика ритма включает классификацию фоновых аритмий, нарушений проводимости и катастрофических аритмий. Одновременно с диагнозом аритмии индицируется ЧСС, частота поджелудочковых и желудочковых экстрасистол и отображается ЭКГ, что дает достаточно полное представление о сердечном ритме. РКС-02 имеет режимы наблюдение за динамикой ритма сердца путем контроля скаттерограммы, ритмограммы и гистограммы распределения R-R-интервалов. Это позволяет использовать прибор для слежения за состоянием больных в кардиологических палатах, в кабинетах функциональной диагностики, для контроля реабилитации и в профилактических осмотрах .
В настоящее время ряд отечественных производителей ведет выпуск кардиомониторов. Фирма “Монитор”(Ростов-на-Дону) разработала кардиомонитор “МЦ - 01”, позволяющий проводить анализ аритмий по одному отведению ЭКГ у 4 пациентов, “Оптим”( Н.Новгород) предложила фотоплетизмографический анализатор сердечного ритма “ Оптим - 510”. Кардиомонитор на базе IBM PC выпускается фирмой “ Геолинк”( Москва) / 36 /.
Особенностью ритмокардиомониторов, используемых для контроля текущего состояния пациентов в медицине критических состояний является применение алгоритмов оценки вариабельности сердечного ритма. Представителем данного класса приборов является ритмокардиомонитор “ ЭЛОН - 001” ( “Новые приборы”, г. Самара) / 36 /.
Ритмокардиомонитор “ЭЛОН - 001” предназначен для оперативного контроля состояния пациента во время анестезии и критических состояний путем наблюдения ЭКГ, слежения за текущими значениями частоты сердечных сокращений и показателями, получаемыми в результате анализа ритма сердца по методике вариационной пульсометрии, которые позволяют в реальном масштабе времени оценить активность симпатического и парасимпатического отделов вегетативной нервной системы.
Прибор обеспечивает непрерывную регистрацию ЭКГ в одном стандартном отведении и анализ сердечного ритма в реальном масштабе времени с вычислением диагностических показателей, тревожную сигнализацию при выходе значения ЧСС за установленные пределы.
Прибор имеет три режима отображения информации:
-режим отображения ЭКГ (режим ЭКГ), при котором обеспечивается индикация значения ЧСС и отображение на жидкокристаллическом графическом дисплее ЭКГ;
-режим отображения гистограммы (режим CP), при котором прибор обеспечивает отображение на дисплее результатов анализа ритма сердца: гистограммы распределения значений длительностей КИ (RR-интервалов ЭКГ) , текущих значений индекса напряжения (ИНБ) /по Р.М.Баевскому/, а также индексов активности симпатического (СИМ) и парасимпатического (ПАР) отделов вегетативной нервной системы или значений статистических параметров распределения КИ;
-режим отображения трендов (режим ТР), при котором обеспечивается индикация на дисплее значения ЧСС, отображение трендов - графиков изменения ЧСС, СИМ или ПАР за 20, 60 или 240 минут (по выбору).
Прибор позволяет подключать принтер для печати трендов ЧСС, СИМ и ПАР (в режиме ТР) или гистограммы распределения КИ (в режиме СР).
Технические данные прибора
| Входное сопротивление, MОм | не менее 100 |
| Полоса пропускания, Гц | 0.5 - 40 |
| Входное напряжение, мВ | 0.05 - 5 |
| Частота квантования, Гц | 250 |
| Амплитуда калибровочного сигнала, мВ | 1 |
| Диапазон определения ЧСС, уд/мин | 30-220 |
| Скорость движения ЭКГ на экране, мм/с | 25, 50 |
| Диапазон установки порогов тревоги по ЧСС, уд/мин | 40-200 |
| Минимальное значение амплитуды R-зубца ЭКГ, мВ | 0.5 |
| Длительность поддиапазона гистограммы, мс | 8 |
| Шкалы значений диагностических показателей
(при объеме выборки 100 КИ): |
|
| ИНБ,ед. | |
| ваготония | менее 80 |
| эутония | 80-160 |
| симпатикотония | более 160 |
| СИМ, ПАР, ед. | |
| слабая активность | менее 15 |
| умеренная активность | 15-30 |
| высокая активность | более 30 |
| Коэффициент ослабления синфазных сигналов, не менее | 28000 |
| Диапазон установки объема выборки | 20-150 |
| Погрешность определения КИ, мс | ±4 |
| Время непрерывной работы прибора, час | 24 |
| Потребляемая мощность от сети переменного тока 220В, 50 Гц, не более, ВА | 10 |
| Габаритные размеры прибора, мм: | 145x270x60 |
| Масса прибора, не более, кг | 2 |
Структурная схема прибора приведена на рисунке 7.
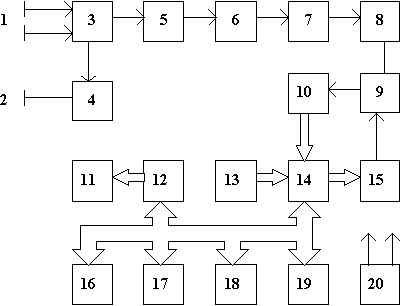
| 1. Электроды
2. Нейтральный электрод 3. Дифференциальный усилитель 4. Драйвер нейтрального электрода 5. Усилитель напряжения 6. Модулятор 7. Оптронная развязка 8. Демодулятор 9. Регулируемый усилитель 10. Аналого-цифровой преобразователь |
11. Дисплей
12. Контроллер дисплея 13. Клавиатура 14. Порт ввода-вывода 15. Цифро-налоговый преобразователь 16. Центральный процессор 17. Таймер 18. ОЗУ 19. ПЗУ 20. Источник питания |
Рисунок 7 - Структурная схема прибора “ЭЛОН - 001”
Электрокардиосигнал (ЭКС) с электродов 1 поступает на дифференциальный усилитель 3, обеспечивающий усиление разностного сигнала и подавление синфазной составляющей помехи. Разностная составляющая наводки от силовой сети подается на драйвер нейтрального электрода 4 и далее в противофазе на нейтральный электрод 2. Это позволяет существенно снизить помеху от силовой сети.
С выхода дифференциального усилителя 3 сигнал поступает на усилитель переменного напряжения 5, где производится усиление ЭКС до уровня, необходимого для нормальной работы модулятора 6. Модулятор преобразует ЭКС в импульсный сигнал, который через оптронную развязку 7 поступает на демодулятор 8, где происходит восстановление ЭКС. Оптронная развязка обеспечивает требуемую электробезопасность прибора, а также повышает помехоустойчивость. С выхода демодулятора ЭКС поступает на регулируемый усилитель 9, обеспечивающий необходимый динамический диапазон.
Далее ЭКС подается на аналого-цифровой преобразователь 10 (АЦП), где преобразуется в 8-разрядный двоичный код. После преобразования в цифровую форму ЭКС вводится в микропроцессорное устройство через порт ввода-вывода 14. Микропроцессорное устройство содержит центральный процессор 16, работающий под управлением программы, размещенной в ПЗУ 19, а также ОЗУ 18 и ряд периферийных устройств. Порт ввода-вывода 14 служит также для установки коэффициента усиления регулируемого усилителя, ввода данных с клавиатуры, для подключения принтера. Таймер 17 формирует необходимые временные интервалы для тактирования АЦП, а также для формирования звуковых сигналов. Контроллер дисплея 12 управляет работой графического жидкокристаллического дисплея 11. Источник питания 20 обеспечивает все напряжения, необходимые для питания узлов прибора.
Для обеспечения высокой надежности и точности работы в приборе использована цифровая обработка ЭКС. Применен цифровой фильтр низких частот с частотой среза 30 Гц, который обеспечивает эффективное подавление сетевой наводки и случайных помех. Кроме того, использован цифровой алгоритм для коррекции дрейфа изоэлектрической линии. Для обнаружения R-зубца применяется корреляционный анализ электрокардиосигнала, что обеспечивает высокую помехоустойчивость.
Математический анализ ритма сердца производится в реальном масштабе времени с индикацией значений ИНБ, СИМ и ПАР. На экран дисплея выводится гистограмма распределения КИ, позволяющая визуально в реальном масштабе времени оценить вид и тенденции ее изменения. На экране также выведены значения статистических параметров распределения КИ: Mo, AMo, D X .
Внешний вид прибора показан на рис. 8.
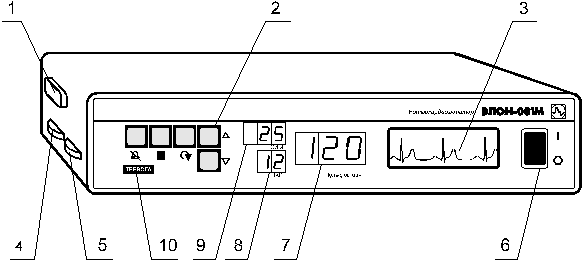
Рисунок 8 - Внешний вид прибора “ЭЛОН - 001”
Основой конструкции прибора является пластмассовый корпус, состоящий из верхней и нижней крышек, а также передней панели.
Электронные компоненты размещены на трех платах. Элементы 3 . . 10 структурной схемы (рис. 6) размещены на плате аналоговых устройств; микропроцессорное устройство и источник питания - на плате цифровой обработки (элементы 12,14 . . 20); дисплей 11 и клавиатура 13 - на плате индикации.
Плата цифровой обработки и плата аналоговых устройств крепятся соответственно к нижней и верхней крышкам, а плата индикации установлена вертикально на передней панели.
Для регистрации электрокардиосигнала используются слабополяризующиеся электрокардиографические электроды с твердым электролитом типа ЭСК-03, характеризующиеся большой стабильностью потенциалов и малым переходным сопротивлением. Их параметры не изменяются в течение длительного времени.
На передней панели прибора расположены (рис. 8):
выключатель питания прибора 6; графический ЖК дисплей 3; цифровой дисплей
7,
8, 9; блок кнопок управления 2. табло “Тревога” 10
На боковой поверхности корпуса прибора расположены:
гнездо разъема 1 для подключения кабеля электродов; регулятор контрастности
дисплея 4; регулятор громкости звуковых сигналов 5;
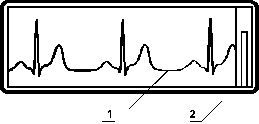
1 - ЭКГ
2 - Калибровочный сигнал
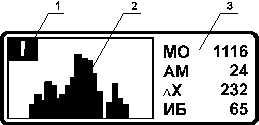
1 - Индикатор количества КИ
2 - Гистограмма распределения КИ
3 - Характеристики распределения КИ
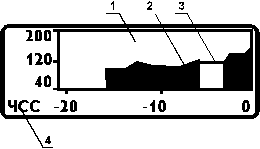
1 - Поле тренда
2 - Тренд ЧСС
Рисунок 9 - Информация, отображаемая на дисплее прибора “ЭЛОН
- 001”
На задней поверхности корпуса прибора расположены гнездо для подключения внешнего регистратора, разъем для подключения принтера и ввод сетевого провода.
Статистическая обработка ряда КИ осуществляется методом скользящей выборки. В зависимости от выбора режима отображения информации на дисплей прибора выводятся различные данные (рис. 9), что позволяет использовать различные методики оценки состояния.
Для работы с прибором можно использовать любой матричный принтер, имеющий команды печати в графическом режиме, совместимые с командами 9 игольчатых принтеров EPSON (система команд ESC/P). Возможно использование также некоторых струйных принтеров, удовлетворяющих этому условию.
Подсоединение принтера к прибору производится с помощью кабеля параллельного интерфейса (кабель Centronics), входящего, как правило, в комплект поставки принтера. Пример распечатки данных приведен на рис.10.
В информационной строке 1 могут быть вписаны необходимые данные о пациенте. Значение “ВРЕМЯ РАБОТЫ” показывает время в часах и минутах, прошедшее от включения прибора до момента запуска печати. На печать выводится три тренда, каждый из которых имеет горизонтальную 4 и вертикальную 2, 6 шкалу.

Рисунок 10 - Распечатка трендов показателей прибора “ЭЛОН - 001”
В поз. 3 показано относительное время (от момента запуска печати), а в поз. 6 показано время в часах и минутах от момента включения прибора. Вертикальная шкала 4 для ЧСС имеет диапазон 40..240 уд/мин, для СИМ - 0..100 ед., для ПАР - 0..50 ед.
Ширина линии трендов 5 соответствует пределам изменения значения соответствующего параметра.
Отметка “НЕТ ДАННЫХ” 7 соответствует интервалам времени, когда показания отсутствовали (при индикации сообщений “НЕТ ПУЛЬСА”, “ПЛОХОЙ КОНТАКТ”).
Важным компонентом клинического мониторинга, определяющим состояние сердечно-сосудистой системы и организма в целом, является контроль кровяного давления .
Движение крови по сосудам представляет собой сложный процесс, зависящий от работы сердца, эластичности сосудистых тканей, тонуса гладкой мускулатуры, количества и вязкости крови, сопротивления потоку крови в капиллярном русле.
Давление крови в сосудах представляет собой гидродинамическое давление, возникающее в результате работы сердца, нагнетающего кровь в сосудистое русло.
Артериальное давление крови (АД) является важнейшим показателем, широко используемым в клинической диагностике. Изменение артериального давления за один сердечный цикл состоит из постоянной составляющей давления и пульсового колебания. Наибольший размах пульсовые колебания давления достигают в крупных артериях, по мере сужения сосудов пульсации падают, становясь неразличимыми в артериолах.
В клинической практике наиболее часто используются следующие параметры, характеризующие АД крови : минимальное (диастолическое), среднее динамическое и максимальное (систолическое) давление ( рис. 11) / 37 /.
Диастолическое давление представляет собой величину минимального давления крови, достигаемую к концу диастолического периода сердечного цикла. Минимальное давление зависит от степени проходимости или величины оттока крови через систему прекапиляров, ЧСС, упруговязких свойств артериальных сосудов.
Систолическое давление равно максимальному давлению, достигаемому в момент, соответствующий выбросу крови из сердца в аорту. Максимальное давление характеризует запас энергии, которым обладает движущаяся масса крови на данном участке сосуда. Максимальное давление складывается из бокового систолического давления (составляющая, действующая на боковую стенку артерии в период систолы) и ударного давления (гемодинамический удар).
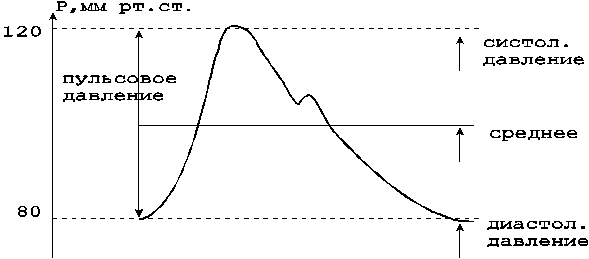
Рисунок 11 - Давление крови в аорте
Среднее динамическое давление определяется интегрированием текущего значения АД за время сердечного цикла. Ориентировочно величину среднего давления можно определить по формуле Вецлера и Богера/ 38/
Рm = 0,42 Рs + 0,58 Рd
или по формуле Хикема
Pm = Pd + (Ps - Pd) / 3 ,
где Рs - систолическое (максимальное) давление,
Рd- диастолическое (минимальное) давление.
Измерение параметров давления крови для мониторинга показателей сердечно-сосудистой системы может осуществляется прямым или косвенным способами.
Прямой, инвазивный способ определения давления крови основан на катетеризации сосуда датчиком давления, имеющим электрический выход. Датчик давления предварительно калибруется в единицах измерения давления крови. Выходной сигнал датчика поступает на устройство обработки, где определяются параметры давления, которые затем передаются на устройства отображения , записи и хранения данных монитора.
Косвенное определение давления крови связано с использованием неинвазивных методик регистрации параметров физиологических процессов, связанных с внутрисосудистым давлением крови. Широкое распространение получили окклюзионные методы, основанные на измерении давления воздуха в манжетке, охватывающей участок тканей, содержащий кровеносный сосуд, которое уравновешивает (компенсирует) давление крови в сосуде под манжеткой.
Используются также методики, основанные на ультразвуковом измерении движения сосудистой стенки, допплеровском измерении скорости кровотока.
Однако результаты измерений, полученные с использованием различных косвенных методов могут значительно отличаться. Это связано с методическими погрешностями косвенных измерений, а также с недостаточно четким определением параметров давления крови, измерение которых часто связано с конкретной методикой регистрации биологических сигналов. Результаты прямых инвазивных измерений могут считаться наиболее достоверными данными для сравнения различных косвенных методик определения параметров давления крови.
В то же время ценность методов измерений, применяемых для целей клинического мониторинга, определяется, в первую очередь, устойчивостью и воспроизводимостью показаний, так как особенности методики можно учесть, сравнивая всю физиологическую информацию о пациенте.
Прямые инвазивные методы измерения давления крови
Внутрисосудистое измерение параметров давления крови с отображением кривой давления на графическом дисплее и цифровых данных на табло монитора является наиболее удобным, точным и достоверным способом непрерывного мониторинга показателей сердечно - сосудистой системы.
Цифровая обработка сигнала внутрисосудистого датчика давления в мониторах позволяет определить необходимые параметры давления крови. Например, при слежении за АД: значения систолического, диастолического, среднего давления, а также рассчитать производные гемодинамические показатели, характеризующие состояние сердечно-сосудистой системы.
Для чрескожной катетеризации при мониторинге АД наиболее часто используется лучевая артерия, в основном из-за доступности, возможностей обеспечения коллатериального кровотока в конечности, большого накопленного экспериментального материала и достаточной безопасности. Использование артериального катетера позволяет дополнительно к мониторингу АД вести повторяющийся отбор проб крови для биохимического анализа.
Датчик давления, используемый для внутрисосудистых измерений в мониторных системах, содержит чувствительный элемент, на который воздействует давление крови. Датчик включает катетер, фиксируемый в исследуемом сосуде. Чувствительный элемент, преобразующий величину давления в электрический сигнал, может конструктивно размещаться вне катетера. В этом случае катетер заполняется жидкостью, передающей давление на чувствительный элемент. В современных конструкциях датчиков давления чувствительный элемент располагается на кончике катетера и отделен от крови тонкой мембраной.
В качестве чувствительного элемента в датчиках давления крови используются различные типы первичных преобразователей давления (тензометрические, емкостные, пьезоэлектрические, полупроводниковые), трансформирующие величину давления за счет упругой деформации чувствительного элемента в изменение его электрических характеристик (сопротивления, емкости, напряжения и др.). Наибольшее распространение в мониторной аппаратуре получили тензометрические датчики, обладающие высокими метрологическими характеристиками.
Надежностью и малыми размерами отличаются волоконно-оптические датчики давления. Они содержат два световода, расположенные внутри катетера. Один световод служит для подачи излучения от источника света на чувствительный элемент, второй соединен с фотоприемником, подключенным к измерительной схеме. Чувствительная к давлению мембрана устанавливается на кончике катетера. С изменением давления крови световой поток, попадающий в приемный световод, оказывается промодулированным по амплитуде, что и регистрируется с помощью фотоприемника. Волоконно-оптический датчик удается сделать диаметром 0,5мм при длине гибкой части катетера до 0,6 м / 39 /.
Измерительная схема, к которой подключен чувствительный элемент датчика, преобразует изменения его электрических характеристик в сигнал, поступающий в устройство обработки монитора.
Точность измерения давления при использовании катетерных датчиков определяется рядом физических факторов. При оценке динамических погрешностей измерений чувствительный элемент датчика, воспринимающий колебания давления, можно рассматривать как гармонический осциллятор под действием внешних сил. Электрический сигнал на выходе датчика давления будет пропорционален величине упругой деформации (смещения) чувствительного элемента, следовательно, в первом приближении он будет описываться решением обыкновенного дифференциального уравнения второго порядка (при допущении, что сила вязкого трения пропорциональна скорости перемещения, сила упругости - перемещению).
Данное решение, в зависимости от значений параметров системы: частоты собственных колебаний fо и коэффициента демпфирования x, имеет апериодический или затухающий колебательный характер. Соответственно, частотная характеристика системы вблизи частоты fо будет иметь подъем или спад в зависимости от величин коэффициента x . Это означает, что если в сигнале пульсации давления присутствуют частотные компоненты, близкие значению fо, то они будут искажаться, т.е. будут возникать динамические погрешности измерений.
Минимизация динамических ошибок при определении параметров АД очень важна, так как систолическое значение АД оценивают по величине зарегистрированного пика пульсации давления в сосуде, определяемого высокочастотными компонентами пульсации давления. Частотный спектр пульсации давления определяется величинами ЧСС и скорости нарастания пика давления. Если допустить, что пульсация давления имеет треугольную форму с времени нарастания не менее 10% от длительности периода колебаний, то при максимальном значении ЧСС равном 180 уд/мин ширина спектра пульсаций давления не превышает 15 Гц.
Для минимизации динамических погрешностей измерений собственная частота датчика должна в 2...3 раза превышать максимальную частоту спектра пульсаций давления.
Для катетерного жидкозаполненного датчика давления крови с жесткой неэластичной трубкой параметры fо, x, без учета механических характеристик чувствительного элемента, который считается в данном случае безинерционным, зависят от диаметра и длины катетера, плотности и вязкости жидкости / 40 /.
С увеличением длины трубки катетера резонансная частота fо падает, что может привести к ее попаданию в частотный диапазон сигнала и к увеличению динамических погрешностей.
Так, для длины катетера l = 150 мм fо = 45 Гц , l = 1800 мм fо = 7 Гц.
Попадание в катетер пузырьков воздуха приводит к увеличению эластичности системы и увеличению x, что также ведет к искажениям регистрируемых пульсаций давления. Кроме того, наличие пузырьков воздуха опасно их проникновением в артериальное русло и развитием эмболии.
Снижение динамической погрешности из-за близости частот спектра пульсации и частоты собственных колебаний датчика может быть достигнуто введением корректирующих цепей в усилитель сигналов датчика, выравнивающих частотную характеристику системы в области возможных искажений.
Катетерные датчики давления с чувствительным элементом, расположенным на кончике катетера, имеют высокую резонансную частоту и свободны от указанных недостатков.
Тензометрические датчики фирмы Millar Instr. / 41 / имеют внешний диаметр катетера от 0.67 до 2.33 мм, длину от 0.75 до 1.4 м, что позволяет их использовать для исследования малых сосудов и в педиатрии.
Технические параметры датчиков:
чувствительность 5 мкВ /В/ мм рт.ст.
сопротивление 1 кОм
диапазон давления -50 ...+300 мм рт.ст.
резонансная частота 10 кГц.
Катетер датчика имеет просвет на рабочем конце для отбора проб крови и введения жидкостей.
Системы катетеризации сосудов, используемые для измерения АД, включают разветвления с клапаном отбора крови и очистки системы, а также для медленного продолжительного (1 ... 3 мл/час) введения раствора гепарина, снижающего риск образования тромбов.
Показания жидкозаполненных датчиков зависят от положения чувствительного элемента датчика относительно тела пациента. Для исключения ошибок измерения чувствительный элемент должен находиться на уровне правого предсердия, в противном случае необходимо ввести поправку на вес столбика жидкости высотой, равной разности уровней положения датчика и сердца. Особенно это важно учитывать при измерении низких значений давления, например, центрального венозного давления.
При измерении АД необходимо учитывать погрешности физиологической природы. Пульсации давления, регистрируемые в периферических артериях, определяются тонусом гладкой мускулатуры, поэтому, например, в лучевой артерии систолическое давление оказывается обычно больше, а диастолическое меньше, чем эти значения в центральной аорте. При изменении сосудистого сопротивления это соотношение может изменяться.
Благодаря развитию техники внутрисосудистой катетеризации, прямой метод измерения давления крови используется для определения различных параметров давления в сердечно-сосудистой системе. Однако инвазивность методики, риск развития сосудистых осложнений ограничивают область применения прямого метода измерений. Чаще всего катетерные измерения используются в интраоперационном мониторинге и в кардиореанимации. В таблице 3 приведены значения физиологической нормы параметров давления, используемых в клиническом мониторинге / 42 /.
Таблица 3 - Значения физиологической нормы параметров давления крови
| Давление, мм. рт.ст. | ||
| Отделы сердца | Среднее значение | Диапазон |
| Правое предсердие (среднее) | 4 | 0....8 |
| Прав. Желудочек (сист/диаст) | 24 / 4 | 15...28 / 0...8 |
| Легочная артерия (сист/диаст., среднее) | 24 / 10 | 15...28 / 5...16 |
| Легочное капиллярное давление заклинивания, (среднее) | 16 | 10...22 |
| Левое предсердие, (среднее) | 9 | 6...15 |
| Левый желудочек, (сист/диаст.) | 130 / 7 | 90...140 / 4...12 |
| Плечевая артерия (сист/диаст, среднее) | 130 / 70, 85 | 90...140 / 60...90, 70...105 |
Клиническое использование прямых методов измерения давления крови
Мониторинг показателей давления крови дает возможность оценить различные функциональные характеристики сердечно-сосудистой системы при проведении лечения..
Мониторинг центрального венозного давления (ЦВД) необходим при назначении вазоактивных препаратов и действии факторов, вызывающих изменение тонуса периферических вен, а также при контроле инфузионной терапии при тяжелой гиповолемии. Измерение ЦВД связано с инвазивной процедурой центральной венозной катетеризации.
Мониторинг ЦВД используется для определения функции правого сердца, а также оценки объема циркулирующей крови. Это связано с тем, что ЦВД отражает степень наполнения правого желудочка и предсердия. Вместе с тем большие вены (торакальные, абдоминальные, проксимальные конечностей) образуют резервуар для значительного объема крови, поэтому ЦВД сильно зависит от объемного состояния сосудов и их тонуса.
Кривую ЦВД отображают на графическом дисплее монитора, т.к. ее форма позволяет оценить работу предсердия и трехстворчатого клапана. При записи ЦВД с усреднением данных за несколько ударов сердца может быть зарегистрирована дыхательная волна, отражающая параметры спонтанного или искусственного дыхания.
Реакция параметров ЦВД на порцию жидкости дает информацию о полном объеме жидкости, венозной эластичности, функции и эффективности правого сердца. Мониторинг ЦВД используется в ситуациях, сопровождаемых большой кровопотерей, а также в сердечно-сосудистой хирургии.
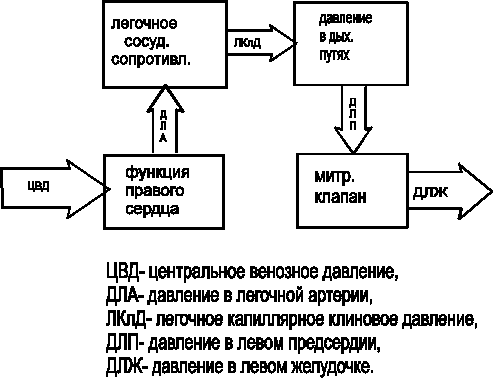
Рисунок 12 - Связь параметров давления сердечного наполнения и давления левого сердца.
Мониторинг давления в легочной артерии (ДЛА) показан при дисфункциях левого желудочка, хирургии аорты, тяжелых легочных заболеваниях. ДЛА оказывается пропорциональным давлению в левом предсердии и левом желудочке в конце диастолы. Диаграмма рис.12 поясняет связь параметров давления сердечного наполнения и давления в левом сердце.
Мониторинг показателей давления дает возможность оценить различные функциональные характеристики сердца при проведении анестезии.
В норме измерение ЦВД достаточно точно отражает давление наполнения как правого, так и левого предсердий. Однако в ряде клинических ситуаций (левожелудочковая недостаточность, интеретициальный отек легких, хронические легочные заболевания, поражения клапанов сердца) существует заметное различие между давлением в левом предсердии и ЦВД (давлением в правом предсердии). Если подобным больным предстоят большие оперативные вмешательства, то им необходим мониторинг легочного кровообращения и давления в левой половине сердца. Эта возможность достигается путем катетеризации через периферическую или центральную вену легочной артерии.
Катетеризация легочной артерии с помощью катетера Swan-Ganz позволяет без катетеризации полостей левого предсердия и желудочка измерить легочное капиллярное давление.
Зонд Snan-Ganz представляет собой четырехпросветный катетер, один из которых снабжен латексным баллончиком, при раздувании которого он увлекается током крови в легочную артерию до заклинивания в одной из ее ветвей. Измерение давления дистальнее этого баллончика дает данные о давлении заклинивания легочных капилляров (ДЗЛК). Если легочные сосуды не поражены склерозом, то по ДЗЛК в достаточной степени объективно можно судить о давлении в левом желудочке в конце диастолы.
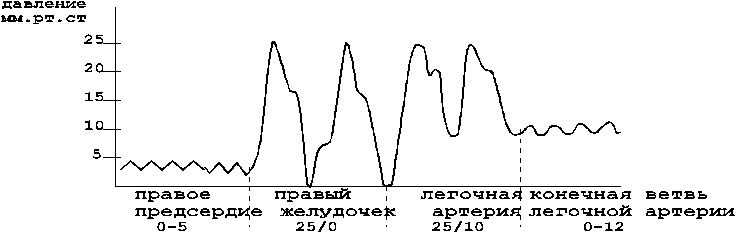
Рисунок 13 - Форма кривых давления при различном положении катетера.
Целесообразность измерения конечно-диастолического давления левого желудочка или левого предсердия (эти показатели равны в диастолу при нормальном открытии митрального клапана) заключается в том, что оно характеризует преднагрузку левой половины сердца.
Наибольшую ценность измерение ДЗЛК приобретает при решении вопроса о природе отека легких, а значит и о выборе пути интенсивной терапии. Если отек легких вызван увеличением гидростатического давления (например, при левопочечной недостаточности), то это проявляется в резком увеличении ДЗЛК. Если отек легких связан с повышением проницаемости легочных капилляров (некардиогенный отек), то показатели ДЗЛК остаются нормальными (10-15 мм рт.ст.)
При правильном расположении баллончика катетера Swan-Ganz в ветвях легочной артерии отверстия трех других катетеров располагаются соответственно в стволе легочной артерии, в правом желудочке и в правом предсердии. Подтверждением этого служит характерная форма кривых давления для каждого катетера (рис.13), по которым определяют топографию его расположения. Возможность измерения конечно-диастолического давления левого желудочка или левого предсердия (эти показатели равны в диастолу при нормальном открытии митрального клапана) заключается в том, что оно характеризует преднагрузку левой половины сердца.
Обычно, катетер Swan-Ganz, устанавливаемый в легочной артерии, позволяет определять сердечный выброс методом термодилюции.
Косвенные методы измерения давления крови
Неинвазивный мониторинг параметров АД может быть реализован путем использования косвенных методов измерения параметров давления крови с помощью окклюзионной манжетки. Наибольшее распространение в клинической практике получило измерение АД в плечевой артерии, при котором окклюзионная манжетка охватывает соответствующий участок правой или левой руки пациента. Увеличение давления воздуха в манжетке (компрессия) приводит к изменению артериального кровотока под манжеткой а также в дистальном участке конечности. Если давление воздуха в манжетке превысит значение диастолического давления крови, артериальный кровоток в руке дистальнее манжетки изменяет свои параметры. Оценка этих изменений и сопоставление их с давлением воздуха в манжетке позволяет определить параметры АД по результатам измерения давления воздуха в манжетке.
Различие используемых на практике окклюзионных методов определения АД заключается в способах оценки соответствия измеренных значений давления воздуха в манжетке и параметров давления в артерии при различных режимах компрессии (декомпрессии) воздуха.
Аускультативный метод измерения АД или метод Н.С. Короткова основан на анализе характерных звуков, так называемых тонов Н.С. Короткова (далее тонов), регистрируемых в простейшем случае с помощью фонендоскопа, в дистальном отрезке артерии, непосредственно у нижнего края окклюзионной манжетки при определенной величине давления воздуха в манжетке.
По методу Н.С. Короткова, первоначально при измерении АД давление в манжетке, охватывающей сосуд, увеличивают до полного прекращения кровотока (артериального пульса) в дистальной части руки. Затем включают плавную декомпрессию (стравливание воздуха из манжетки), В момент открытия артерии кровотоку, начинают прослушиваться первые тоны. В этот момент давление крови на вершине артериальной пульсации становится чуть больше давления воздуха в манжетке и артерия на короткое время “открывается”, порождая звуковые колебания. Давление в манжетке, соответствующее появлению первых тонов, принимается в методе Н.С. Короткова за значение систолического АД. Происхождение регистрируемых тонов может объяснить турбулентным движением крови по сжатому сосуду, а также неустойчивым поведением стенок после “открытия” сжатой артерии, приводящим к звуковым колебаниям характерного спектрального состава.
При дальнейшей плавной декомпрессии ( около 3 мм рт. ст. на один удар пульса) характер звуковых тонов изменяется, они становятся глуше (их частотный спектр сдвигается в сторону более низких частот) и затем они исчезают. Считается, что момент приглушения или исчезновение тонов соответствует равенству давления воздуха в манжетке минимальному динамическому давлению крови, то есть диастолической величине АД. Критерий приглушения тонов для отсчета диастолического значения АД признается большинством авторов / 40 /.
В ряде случаев, при патологии сосудистой стенки исчезновение тонов происходит при весьма малых значениях давления в манжетке. В случае кардиогенного шока или применения препаратов с вазопрессорным эффектом происходит задержка в появлении тонов, что приводит к занижению АД по результатам аускультативных измерений. Напротив, низкая эластичность сосудистых тканей, расположенных под манжеткой, например, при септическом шоке, может привести к завышению результатов определения АД.
Следует отметить, что спектр тонов расположен в более высокочастотной области, чем звуковые колебания, регистрируемые при анализе артериальных пульсаций давления. Поэтому выделение тонов можно осуществить автоматически путем частотной фильтрации сигналов микрофонного датчика, расположенного под манжеткой.
Метод Н.С. Короткова получил широкое распространение в клинической практике и используется при построении мониторов АД. Считается, что этот метод дает погрешность не более 2-3 мм рт.ст. / 38 /. Измерение давления в манжетке осуществляется с помощью тензометрического или емкостного датчика давления. Для обнаружения тонов Н.С. Короткова используются миниатюрные пьезомикрофоны, работающие в полосе частот 10...80 Гц / 43 /. Совместная запись сигналов двух датчиков, регистрирующих давление воздуха в манжетке и тоны, показана на рис.14.
Для снижения погрешностей измерений, обусловленных близостью спектров тонов и звуков артериальных пульсаций, попадающих в микрофон, а также для ослабления артефактов движения в мониторах АД используется дифференциальный метод выделения тонов. В нижней части окклюзионной манжетки устанавливается микрофон, состоящий из двух чувствительных элементов А и Б (рис.15).
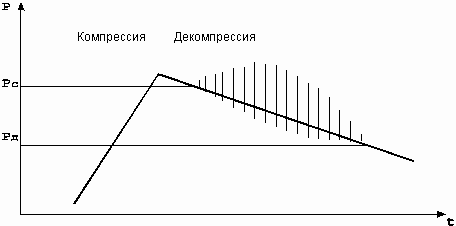
Рисунок 14 - Кривая давления воздуха в манжетке с наложенными тонами Н.С. Короткова
При снижении давления в манжетке до систолического значения ниже манжетки регистрируются пульсации давления и тоны. Акустические характеристики манжетки таковы, что она плохо передает высокочастотные тоны, поэтому сигналы, регистрируемые микрофоном по каналам А и Б, будут различаться. По каналу А регистрируется весь спектр колебаний, в который входят пульсации давления, тоны, артефакты движения. По каналу Б регистрируются сигналы в диапазоне 0,5...5 Гц, в который попадают только пульсации давления и артефакты движения.
Таким образом, при вычитании сигналов каналов А и Б можно получить точное выделение тонов (рис.16), что существенно снижает погрешности измерения АД.
Пальпаторный метод измерения параметров АД является одним из самых старых методов оценки параметров гемодинамики, применяемых анестезиологами до настоящего времени. Метод основан на использовании окклюзионной манжетки, накладываемой на плечо, создании в ней давления воздуха, сжимающего артерию, и определении значения давления в характерные моменты изменения пульса, контролируемого на дистальном участке артерии (в простейшем случае путем пальпации) при плавной компрессии (декомпрессии) воздуха в манжетке.
Обнаружение пульсаций давления крови на дистальном участке артерии может производиться сфигмографическими или плетизмографическими методами. Эти методы основаны на регистрации движения артериальной стенки или изменения объема тканей (например, пальца руки или ноги) при пульсации давления крови. Чаще всего используются три способа измерения артериальной пульсации:
реографический, основанный на измерении изменений электрического сопротивления переменному току участка тканей, содержащего артериальный сосуд;
механический, реализуемый с помощью микрофона или датчика давления, накладываемого на пульсирующий участок кожи, например, в локтевой ямке;
оптический (фотоплетизмографический), реализуемый с помощью фотометрирования изменений оптической плотности тканей с артериальной кровью, например, при просвечивании ногтевой фаланги пальца руки.
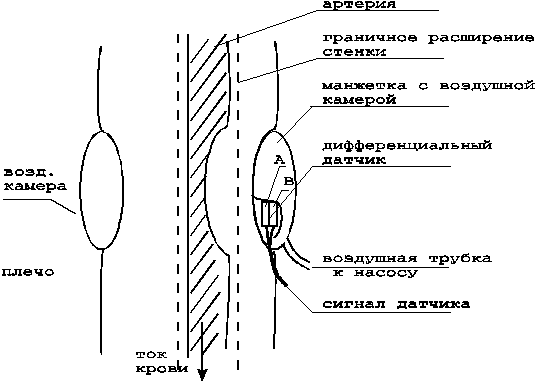
Рисунок 15 - Дифференциальный датчик тонов Короткова.
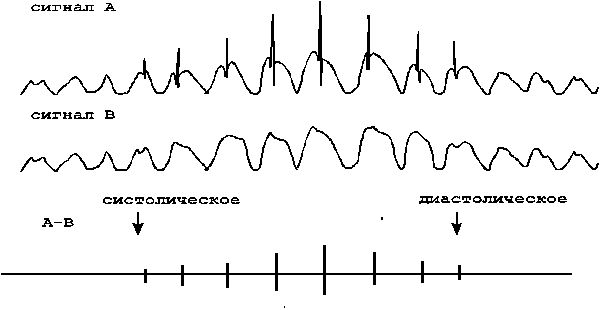
Рисунок 16 - Выделение тонов при вычитании сигналов дифференциального датчика
Значение давления воздуха в манжетке, при котором появляется пульс, принимается за систолическое АД (рис.17). Определение минимального давления данным способом сопряжено со значительными погрешностями. За критерий равенства давления воздуха в манжетке минимальному давлению может быть принято уменьшение амплитуды пульсаций при декомпрессии воздуха / 38 /. Однако этот критерий не является достаточно точным и однозначным для автоматического определения параметров АД. Только при реографической записи и ручной расшифровке данных могут быть получены удовлетворительные результаты / 44 /.
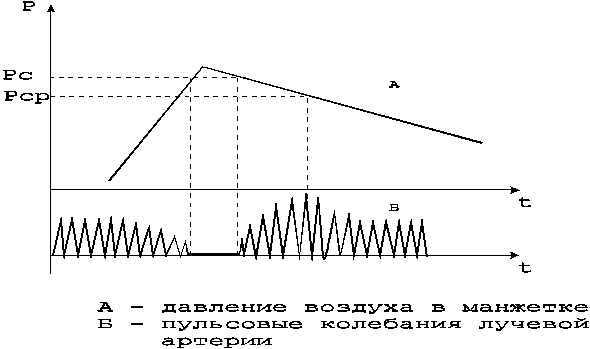
Рисунок 17 - Измерение АД пальпаторным методом
Осциллометрический метод измерения параметров АД связан с анализом пульсаций давления (осцилляций), возникающих в окклюзионной манжетке, сжимающей артерию, в режиме компрессии (декомпрессии) воздуха. Для регистрации осцилляций в воздушную магистраль манжетки вводят датчик давления с необходимыми динамическими характеристиками (аналогично датчику прямых инвазивных измерений).
Определение параметров АД производится по результатам измерения давления воздуха в манжетке, соответствующим характерным изменениям осцилляций воздуха при плавной компрессии (декомпрессии). Определенные изменения осцилляций происходят при равенстве давления воздуха в манжетке значениям параметров АД крови. Для выявления изменений осцилляций, соответствующих значениям систолического, среднего, диастолического давления крови анализируют амплитуду и форму осцилляций. Существуют различные методики анализа, используемые при построении автоматических мониторов давления.
Анализируя амплитуды осцилляций во время компрессии (декомпрессии), можно выделить области характерных изменений амплитуд, при которых давление в манжетке соответствует искомым параметрам АД. Так, среднее динамическое давление определяется как минимальное давление в манжетке, соответствующее максимальной амплитуде осцилляций (рис.18).
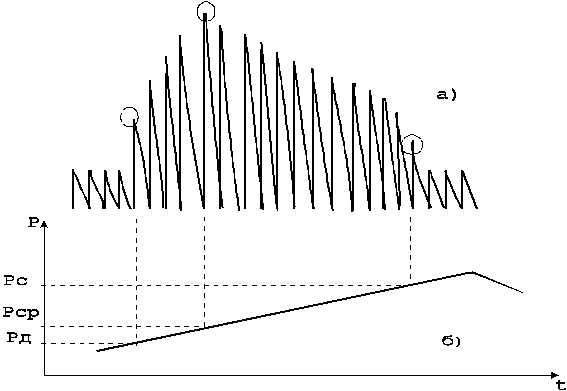
а - осцилляции, б - изменение давления в манжетке
Рисунок 18 - Изменение амплитуды осцилляций при компрессии воздуха в манжетке
Систолическое значение давления можно определить по критерию прекращения пульсаций дистального отрезка артерии конечности пальпаторным методом или по исчезновению осцилляций в дистальной камере манжетки в режиме компрессии. В последнем случае манжетка выполняется двухкамерной, дистальная ее часть звукоизолируется от проксимальной. Это связано с тем, что при отсутствии артериальной пульсации в дистальной части конечности осцилляции в проксимальной части манжетки сохраняются из-за ударов пульсовой волны давления о
проксимальную часть манжетки. Поэтому осцилляции, регистрируемые датчиком давления воздуха в манжетке, не падают до нуля, а лишь уменьшаются (рис.18). Резкое уменьшение амплитуды осцилляций может быть принято за критерий определения систолического давления / 38 /. При снижении давления в манжетке ниже минимального (диастолического) также можно зафиксировать снижение амплитуды осцилляций, что позволяет фиксировать величину диастолического давления.
Однако многие исследователи отмечают, что изменение амплитуды осцилляций может иметь монотонный характер в области систолического и диастолического значений АД, что вносит значительные ошибки в измерения. Достаточно просто (после фильтрации артефактов и дыхательных волн) определяется максимальная амплитуда осцилляций, соответствующая среднему динамическому давлению.
Измерение этой величины позволяет реализовать относительно простой алгоритм анализа осцилляций для определения параметров АД, основанный на оценке относительной амплитуды осцилляций по сравнению со значением максимума. Снижение амплитуды до уровня 0,4 максимума при компрессии используется для отсчета систолического давления, а уменьшение до уровня 0,6 при декомпрессии - диастолического давления. Однако, коэффициенты уменьшения зависят от значения ЧСС и нуждаются в коррекции при тахикардии и брадикардии / 45 /.
Значения амплитуд осцилляций, соответствующих параметрам АД, можно вычислить по регрессионной модели, связывающей искомые значения и амплитуду фоновых осцилляций, регистрируемых в манжетке при значениях давления воздуха в манжетке, превышающего систолическое на 20 ... 40 мм рт.ст.. Регрессионная модель представляет собой степенной полином, коэффициенты которого рассчитываются путем обработки большого массива измерений АД / 46 /.
Анализ первой производной осцилляций - тахоосцилляций, сделанный Н.Н. Савицким / 38 /, позволяет достаточно точно определить диастолическое АД. Тахоосциллограмма имеет положительную часть, относящуюся к систолической части осцилляций, и отрицательную, характеризующую скорость опорожнения сжимаемой артерии (рис.19).
Отрицательная часть тахоосцилляций изменяет свои параметры в тесной зависимости от величины давления, оказываемого манжеткой на артерию / 47 /. За точку отсчета диастолического давления принимается начало роста отрицательной части тахоосциллограммы при плавной компрессии воздуха в манжетке. При дальнейшей компрессии воздуха наблюдается увеличение амплитуды и достижение максимума. По Н.Н.Савицкому / 38 /, это критерий равновесия величины давления в манжетке и значения бокового систолического давления крови.
Величина систолического давления может быть определена по начальному участку роста тахоосцилляций при плавной декомпрессии воздуха в манжетке.
Для определения параметров АД может быть использован анализ второй производной осцилляций. В этом случае значение систолического АД принимается равным величине давления в манжетке, соответствующей максимуму огибающей осцилляций “отрицательного” участка кривой (рис.20). Значение диастолического АД равно давлению в манжетке, соответствующему максимальной скорости убывания “положительного” участка / 48 /.
Рассмотренные методы определения параметров АД реализуются в условиях режима плавной декомпрессии (компрессии) воздуха в окклюзионной манжетке. Выбор скорости и линейность декомпрессии оказывают влияние на точность измеряемых параметров. Скорость декомпрессии для минимизации погрешности поддерживают на уровне 2 мм рт.ст. на один межпульсовой интервал.
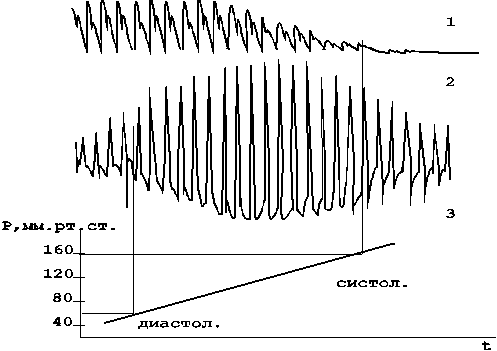
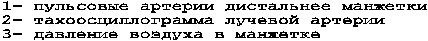
Рисунок 19 - Тахоосциллограмма плечевой артерии
Для поддержания линейности декомпрессии используются специальные клапаны - линеаризаторы воздушного потока / 49 / или схемы автоматического поддержания скорости декомпрессиии с электромеханической обратной связью. В простейшем варианте используется набор клапанов с различным воздушным сопротивлением, автоматически подключаемых к воздушной магистрали декомпрессии в зависимости от давления в манжетке .
Измерение параметров АД в рассмотренных методах осуществляется циклически. Частота циклов измерений ограничена условием поддержания нормального кровотока в дистальной части конечности, так как частое сжатие артерии и нарушение кровотока при компрессии воздуха в манжетке, а также венозный застой в конечности могут привести к неблагоприятным последствиям. Кроме того, имеются наблюдения о колебаниях АД при очень частых процедурах подобных измерений.
Мониторинг в критических состояниях требует непрерывного слежения за параметрами АД, так как важные изменения давления могут происходить достаточно быстро. Непрерывный неинвазивный мониторинг может быть реализован по методу слежения за пульсовыми колебаниями артерии, разработанному J.Penaz / 50 / и дающему минимальное сжатие сосудистой стенки артерии.
Метод включает определение пульсации артерии под манжеткой при помощи фотоплетизмографического датчика, размещаемого в манжетке. Для измерений выбирается артерия первого пальца кисти руки. Давление воздуха в манжетке регулируется по принципу отрицательной обратной связи; при увеличении просвета артерии давления воздуха - уменьшается, при уменьшении - увеличивается, то есть давление воздуха в манжетке отслеживает артериальную пульсацию в пальце, не вызывая сильного сжатия артериальной стенки.
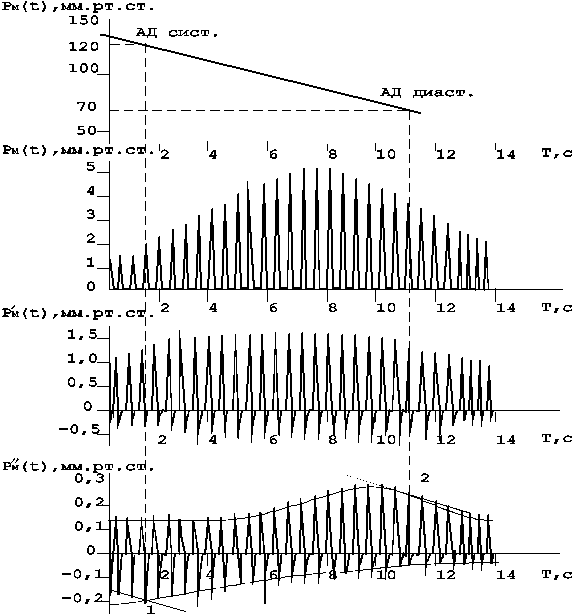
Рисунок 20 - Определение показателей АД по второй производной тахоосциллограммы.
Зарегистрированная датчиком пульсация давления используется для осциллометрической обработки с целью вычисления параметров АД. Кривая пульсации давления выводится на дисплей для наблюдения за артериальным кровотоком. Периодические калибровки, уточняющие параметры АД, проводятся также по осциллометрической методике.
Изучение кровотока дистальной части пальца показывает мягкую гипоксемию после 10 минут измерений, однако уменьшение PО2 стабилизируется на приемлемом уровне, что позволяет сделать вывод о возможности использования метода J.Penez при длительных операциях / 42 /. Метод хорошо согласуется с прямыми измерениями АД и рекомендуется при продолжительных исследованиях АД / 51 /.
Непрямые методы измерения венозного давления (ВД) крови не оправдали себя из-за большого расхождения полученных данных с фактической величиной давления. Вместе с тем, ряд методов измерения ВД непрямым способом может быть использован во врачебной практике.
По методу Гертнера наблюдают за тыльной поверхностью руки при ее медленном поднятии и фиксируют момент спадения вен. Расстояние от максимальной точки поднятой руки до предсердия соответствует величине венозного давления. Метод неточен, однако подкупает своей простотой и доступностью.
Более точен гидростатический метод измерения ЦВД, заключающийся в перемещении обследуемого с помощью поворотного стола из горизонтального положения в вертикальное и наблюдении за изменением характера пульсаций в манжете, наложенной вокруг шеи. Величина падения гидростатического давления соответствует величине ЦВД и близка к данным прямых измерений.
F. Вurstin / 37 / предложил использовать флебограмму яремной вены (югулярную флебограмму) для оценки систолического давления в легочной артерии. Запись центрального венозного давления производится с помощью емкостного датчика, расположенного в области вены. Параллельно регистрируется ЭКГ, ФКГ и сфигмограмма сонной артерии, необходимые для точной идентификации зубцов флебограммы. По номограмме, учитывающей ЧСС и длительность фазы изометрического расслабления, определяемой по флебограмме и ФКГ, рассчитывается уровень давления в легочной артерии. Корреляция с прямым методом измерения составляет r = 0,94.
Аппаратура мониторного контроля параметров
давления крови
Аппаратура для измерения параметров давления крови входит в состав практически всех современных многоканальных мониторных систем (таблица 1).
В таких системах прямому инвазивному измерению параметров давления крови может отводиться несколько измерительных каналов для определения параметров давления в различных точках сосудистого русла и отображения кривых давления на графическом дисплее монитора.
Аппаратура неинвазивного измерения АД также входит в состав мониторных систем, однако она имеет более широкое клиническое применение, поэтому мониторы давления, основанные на косвенных методах определения параметров АД, выпускаются в виде отдельных приборов (таблица 4) / 43 /.
Аппаратура прямого инвазивного измерения давления крови представляет собой измерительный канал, преобразующий электрический сигнал катетерного датчика, пропорциональный величине давления крови, в цифровую форму для дальнейшей обработки в мониторе. Структурная схема канала с использованием тензодатчика давления показана на рис. 21 .
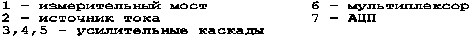
Рисунок 21 - Структура тензометрического измерителя давления
Чувствительный элемент датчика включен в измерительный мост 1, питаемый для снижения погрешности измерений от источника стабильного тока 2. Для усиления сигнала датчика до уровня, необходимого для использования полной шкалы АЦП, служат каскады 3, 4, 5. Дифференциальный усилитель 3 с частотной коррекцией для устранения помех, согласует мост 1 с последующими каскадами усиления. В усилителе 4 осуществляется установка нуля, необходимая при тарировке датчика.
Усилительный каскад 5 и мультиплексор 6 по сигналу управления от процессора монитора осуществляют цифровую регулировку усиления сигнала давления для согласования амплитуды сигнала со входом АЦП 7. Для снижения динамической погрешности измерений усилитель 5 может быть охвачен частотно-зависимой цепью коррекции.
Неинвазивные мониторы параметров АД строятся с использованием осциллометрического
или аускультативного метода измерения, а иногда совмещают оба метода (таблица
4). Если аппаратура входит в состав многоканальной мониторной системы,
то для повышения точности измерений используется канал ЭКГ, позволяющий
синхронизировать обнаружитель пульсовой волны монитора.
Таблица 4 - Характеристики мониторов АД.
|
|
|
USD |
| Advanced Medical Products | ||
| Micro FD ABP | Параметры АД измеряются аускультат. и осцилломет. метод.; двойное измерение, возможность выделения R-зубца для повышения точности. | 4990 |
| New Age Combo FD ABP+Holter | Система с двумя функциями выполняет часовое амбулаторное измерение АД и синхронное полное Холтер. мониторирование; АД измеряется аускультат. и осциллометрическим методами, отчет включает полный график АД, выявленные эпизоды, отмеченные участки ЭКГ. | 11 990 |
| Biosensor Corp. | ||
| BioABP | Аускультативный амбулаторный монитор АД на 24-48ч. с Холтер. мониторингом, центральной станцией или ПК; измерение и запись АД с установленным интервалом: систолическое, диастолическое, среднее АД, ЧСС; ослабление артефактов, частичная нагрузка на сосуды, запоминание пациентов и полного тренда. | |
| Carolina Medical. Systems Inc. | ||
| VascuMap АР-102 | Осциллометр. измеритель АД, показ. систолическое, диастолическое, среднее и ЧСС, автоматическая запись с установкой пределов тревоги и сигнализацией на табло; 22 различных манжетки для пальца, руки и ноги для сегментарных измерений. | 29995 |
| Vascumap
АР-102R |
То же самое, с печатью данных на узкую ленту, включая форму пульсовой волны, автоматическое выделение пульсов. артериальной волны, съем и запись венозной плетизмограммы Разработан для сосудистых лабораторий. | 4995 |
| Vascumap
АР-102V |
Дополнительно включает калибратор для измерения пульсового объема в куб. см. | 7995 |
| Colin Medical Instr. Corp. | ||
| Press-Mate 8800 | Портативный монитор АД, осциллометрия с линейной декомпрессией воздуха для взрослых, детей и неонатального применения; память записей до 152 измерений. | 5295 |
| Series NBS Medical Inc. | ||
| 6100 Series | Автоматический осциллометр. измеритель и монитор; цифровой дисплей; систолич., диастолич., среднее АД и ЧСС, тревоги по всем параметрам, установка параметров сохраняется в энергонезависимой памяти; интерфейс RS232, встроенный термопринтер | 2250 |
| Oxford Instr.Medical Systems Div. | ||
| Medilog DX | Амбулаторная мониторная система АД; запись информации о АД и ЧСС до 72 часов; програм. временных интервалов измерения; аускультат. метод ; для повышения точности детект. тонов Короткова; настольное исполнение для помещений; редактирование в стандарте ПК | 2 750 |
| Po-Ne-Mah. Inc. | ||
| BPAnalysis &
Archive System |
Интерфейс с аналоговыми входами для клинических мониторных систем; возможен анализ давления до 16 каналов в реальном времени, включающий пик систол., мин. диастол., средн., пульсов., мгновен. ЧСС, время пика давления, время выброса, max/min произв. давления, процент времени восстановления, Q-A интервал восстановления. |
|
| Pulse Metric Inc. | ||
| DP2000A | Автоматический неинвазивный пульс. динамический монитор АД в виде платы для ПК |
|
| Suntech. Medical Instr. Inc. | ||
| Accutracker 11 | Амбулаторный монитор АД; аускультативный метод ; R-зубец разрешает измерение АД; систолическое, диастолическое , среднее АД и ЧСС, усреднение, отчет на принтере или на ПК |
|
| Marquett Electron. Inc. | ||
| Solar & Eagle Monitors | Неинвазивное и 2 инвазивных измерения давления; 4 кривых и цифровой дисплей ЭКГ, темпер., SаО2 | |
| Utah.Medical Produc. Inc. | ||
| Deltran П | Интегральный датчик для инвазивного мониторинга давления; клапан сброса давления, универсальный разъем |
|
| Meditech | ||
| АВРМ-02 | Носимый монитор, запись данных в течение 24...48час, осциллометр. метод, число записей-300, масса 390г, подключение к ПК | 1800 |
Функциональная схема монитора АД, реализующего аускультативный и осциллометрический метод измерения, показана на рис. 22.
Аускультативный измерительный канал монитора содержит дифференциальный акустический датчик, встроенный в нижнюю часть плечевой окклюзионной манжетки 1, усилитель разностного акустического сигнала 3 и фильтр тонов Короткова 5. Воздушная магистраль, соединенная с манжеткой, включает компрессор 16, создающий максимальное давление в манжетке, обычно выбираемое на 20...30 мм рт.ст. выше конечного систолического давления крови. Клапаны, включенные в магистраль, служат для быстрого сброса давления (14), плавной декомпрессии (15), предохранения магистрали от избыточного давления (17).
Осциллометрический канал включает датчик давления 4 тензометрического типа, соединенный с манжеткой 1, который преобразует давление в манжетке в электрический сигнал, усиливаемый дифференциальным каскадом 6. Постоянная составляющая сигнала, пропорциональная постоянной составляющей давления в манжетке, выделяется усилителем постоянного тока с ФНЧ 7, выделение и усиление сигнала пульсаций давления осуществляется с помощью усилителя с ФВЧ 8. Контроллер 11, включающий процессор, ОЗУ, ПЗУ, соединен с дисплеем и осуществляет управление элементами воздушной магистрали, а также мультиплексором 9 и АЦП 10.
Сочетание аускультативного и осциллометрического каналов позволяет реализовать гибкие алгоритмы определения параметров АД - значений систолического, диастолического, среднего давления, и тем самым повысить точность измерений и их надежность.
Так, среднее АД измеряется осциллометрическим методом, даже в тех случаях, когда звуковые сигналы тонов очень слабы.
Мониторы АД имеют автоматический режим периодических измерений с интервалом времени от 1 до 60 минут, а также систему тревожной сигнализации при выходе измеряемых параметров за установленные границы.
Технические характеристики мониторов АД, выпускаемые в различных странах, удовлетворяют требованиям стандартов (стандарт Британской ассоциации гипертонии, национальный стандарт США для электронных сфигмоманометров).
Пределы измерения давления устанавливаются чаще всего от 0 до 250 мм рт.ст. Точность отсчета давления определяется как ± 3 мм рт.ст.. Эта величина является инструментальной погрешностью измерения давления воздуха в окклюзионной манжетке. Оценка погрешности измерения параметров АД затруднена из-за отсутствия адекватного метрологического обеспечения.
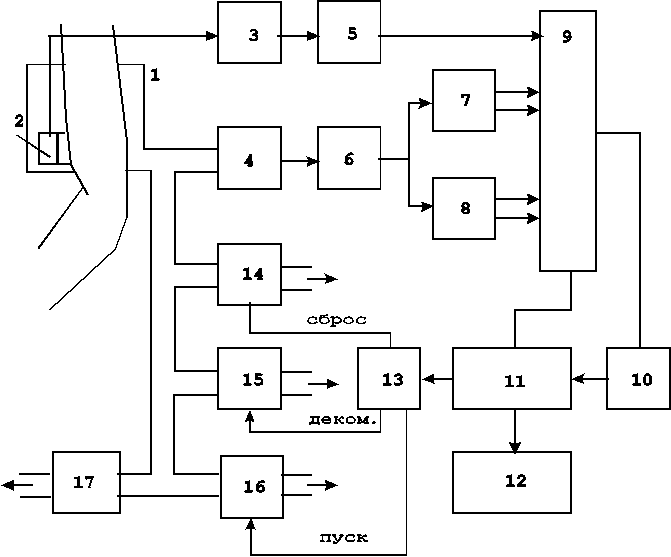
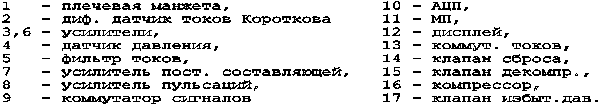
Рисунок 22 - Функциональная схема монитора АД с использованием двух косвенных методов измерения
Американский стандарт рекомендует сопоставительную методику определения погрешности измерения АД автоматизированными сфигмоманометрами. В стандарте учтено, что основная масса диагностических данных по определению АД получена ручным аускультативным способом.
Методика оценки погрешности включает одновременное измерение параметров АД с помощью фонендоскопа и исследуемого сфигмоманометра с использованием одной окклюзионной манжетки / 48 /. Для уменьшения погрешности, связанной с субъективным восприятием наблюдателей тонов Н.С. Короткова, используется фонендоскоп с разветвленными слуховыми трубками для получения независимых результатов двумя наблюдателями. Средняя величина результатов наблюдений используется при оценке точности.
В соответствии с данной методикой следует провести 3 измерения параметров АД в течение 30 мин для каждого пациента. Количество пациентов не должно быть менее 85 человек. Стандарт регламентирует, чтобы среднее значение разницы величины АД, определенной по всем измерениям с помощью прибора и наблюдателями, не превышало ± 5 мм рт.ст.. Среднеквадратичное отклонение не должно быть более 8 мм рт.ст..
Неинвазивные мониторы непрерывного слежения за параметрами АД, с отображением кривой изменения давления на дисплее, строятся по методу слежения за поперечным размером сосуда при пульсовых колебаниях артериальной стенки.
Функциональная схема монитора фирмы Ohmeda, реализующего данный метод, представлена на рис.23.
Пальцевая окклюзионная манжетка 1 содержит фотоплетизмографический датчик, включающий излучатель 2, питаемый от источника 4, и фотоприемник 3, дающий сигнал, пропорциональный величине диаметра пальцевой артерии. Воздушная магистраль прибора, связанная с манжеткой, включает компрессор 11, клапан с пропорциональным управлением 9 и датчик давления 10. В петле электромеханической обратной связи происходит формирование сигнала, пропорционального диаметру артерии, и напряжения управляющего работой клапана 9.
Рисунок 23 - Функциональная схема монитора АД по методу слежения за изменением давления в манжетке
В результате, при пульсации сосуда, с увеличением просвета артерии давление в манжетке уменьшается, а при уменьшении - увеличивается. Таким образом, поддерживается номинальная величина просвета артерии, задаваемая микропроцессором 12.
Давление воздуха в манжетке отслеживает колебания АД на протяжении сердечного цикла и после преобразования в электрический сигнал датчиком 10 поступает на АЦП 13 для обработки в микропроцессоре по осциллометрической методике.
На экран дисплея 14 выводятся кривая давления и вычисленные значения параметров АД. В приборе предусмотрена периодическая калибровка по сигналу от микропроцессора 12, подаваемому на переключатель 7. При этом обратная связь размыкается и под действием напряжения калибровки осуществляется поиск размера сосуда, при котором пульсации давления достигают максимума.
Для предотвращения искажений фотоплетизмографического сигнала палец с манжеткой при проведении процедур изменения АД необходимо надежно зафиксировать.
В мониторе АРМ 770 (Cortronic USA), построенном по аналогичному принципу, используется стандартная плечевая манжетка с постоянным низким давлением около 30 мм рт.ст. и следящая система за расширением сосудистой стенки с целью определения параметров АД /42 /.
Сердечный выброс характеризует насосную функцию сердца, то есть его способность к нагнетанию крови в артериальное русло. Чаще всего оцениваются два параметра сердечного выброса: ударный (систолический) объем (СО), равный количеству крови, выбрасываемому за одно сердечное сокращение, и минутный объем кровообращения (МОК), равный объему крови, проходящему через сердце за минуту.
Минутный объем кровообращения равен произведению величины систолического объема на значение ЧСС.
Величина сердечного выброса гомеостатически поддерживается в организме в соответствии с потребностью метаболизма тканей, что делает этот показатель важным индикатором функционирования сердечно-сосудистой системы, отражающим процессы нервной и гуморальной регуляции. Определение параметров сердечного выброса, а также производных показателей, характеризующих центральную гемодинамику, играют важную роль в клиническом мониторинге.
Разработаны прямые методы определения сердечного выброса, связанные с катетеризацией сердца, а также неинвазивные, основанные на ультразвуковых (допплеровских), эхокардиографических, реографических и фотоплетизмографических методах оценки параметров кровотока.
Совершенствование техники клинического мониторинга за последние годы связывают с достижением неинвазивных методов измерения сердечного выброса, дающих при простоте их реализации оперативную информацию о состоянии сердечно-сосудистой системы пациента во время проведения хирургических вмешательств, а также в послеоперационном периоде.
Инвазивное измерение сердечного выброса
В основе инвазивных методов измерения сердечного выброса, используемых в клиническом мониторинге, лежит принцип A.Fick / 38 /. По A.Fick, оценка объемной скорости кровотока осуществляется с помощью введения (инъекции) вещества индикатора внутрь сосуда в поток крови и определения изменения концентрации индикатора во времени. В этом случае объемная скорость потока крови оказывается равной отношению количества индикатора, введенного в единицу времени, к изменению его концентрации на изучаемом участке сосудистого русла.
В газовых методах оценки сердечного выброса в качестве индикатора используют газ, растворимость которого в крови известна. По прямому методу A.Fick в качестве такого газа используют кислород. Тогда, для определения сердечного выброса по количеству крови проходящей через легкие, измеряют потребление кислорода при дыхании и содержание кислорода в артериальной и смешанной венозной крови:
МОК = 100ПО2 / ( [O2]a - [O2]в) ,
где МОК, л/мин - минутный объем кровообращения,
ПО2, л/мин - потребление кислорода при дыхании,
[O2] a,.% - содержание кислорода в артериальной крови,
[O2] в,.% - содержание кислорода в венозной крови.
Для получения пробы артериальной крови необходимо пунктировать артерию, а для пробы смешанной венозной крови - производить зондирование сердца, забирая кровь из легочной артерии. Потребление кислорода пациентом и уровень гемоглобина, или кислородную емкость крови, определяют одновременно. Для расчета минутного объема кровообращения, по данным, полученным в результате анализа проб крови, определяют артерио-венозную разность по кислороду в объемных процентах / 37 /. Прямой метод A.Fick, являясь фундаментальным методом оценки параметров гемодинамики, обеспечивает высокую воспроизводимость оценки сердечного выброса, однако долгое время из-за сложности процедур его реализации он использовался только в физиологических исследованиях и функциональной диагностике. В клиническом мониторинге лишь в последние годы появились возможности реализации метода A.Fick, благодаря разработке быстродействующих мониторов выдыхаемых газов, а также появлению волоконно-оптических оксиметров, позволяющих непрерывно определять артерио-венозную разность по кислороду с помощью волоконных катетерных датчиков, вводимых в соответствующие сосуды.
Метод разведения индикатора заключается во введении в поток крови известного количества вещества-красителя и измерении изменения его концентрации на дистальном участке сосудистого русла. В качестве индикатора используется красящее вещество (интактное вещество, имеющее острый пик поглощения при спектрофотометрировании), быстро покидающее сосудистое русло, что удобно при частых повторных определениях значений сердечного выброса. Введенный в вену краситель проходит через правое сердце, малый круг кровообращения, левое сердце и поступает в артерии, где и определяют его концентрацию. Минутный объем кровообращения может быть определен на основе уравнения Stewart-Hamilton:
где Iо, г - количество введенного красителя,
[ i ](t), г/л - концентрация красителя в артериальной крови,
T, с - время измерения.
Для получения зависимости [ i ](t) (так называемой, кривой разведения красителя) необходим многократный забор проб артериальной крови и их спектрофотометрический анализ.
Кривую разведения можно записать с помощью ушного оптического датчика, регистрирующего поглощение в области красного света. В этом случае можно отказаться от проб артериальной крови, ограничиваясь введением красителя в вену и забором двух тест-проб венозной крови /37/.
Прежде чем весь введенный краситель пройдет мимо места забора проб (или точки расположения регистрирующего датчика), первые его порции рециркулируют, что сопровождается подъемом кривой разведения (рис.24). При обработке кривой разведения, перед интегрированием зависимости для расчета величины МОК, падающий участок кривой разведения аппроксимируют экспонентой для устранения ошибок, связанных с рециркуляцией красителя.
Метод термодилюции является одним из вариантов метода разведения, при котором в качестве индикатора используется охлажденный (до +5° С) раствор, например, глюкозы, вводимый через катетер в правое предсердие.
Рисунок 24 - Кривая разведения красителя
Для зондирования сердца используется катетер Swan - Ganz, имеющий на конце малоинерционный датчик температуры - термистор (постоянная времени около 60 мс). На поверхности катетера на определенных расстояниях до его конца (6 и 16 см) расположены электроды для контроля внутрисердечной ЭКГ, отверстия для болюсного введения индикатора (21 см), отверстие для инфузии растворов (31см ) ( рис.25).
Катетер проводится через верхнюю полую вену таким образом, что термистор располагается в стволе легочной артерии, а отверстие, через которые вводится индикатор - в правом предсердии.
Таким образом, путем измерения изменения температуры крови в легочной артерии с помощью термистора определяется функция правого сердца. В данном случае уравнение Stewart-Hamilton имеет вид
гдеV, л - объем вводимого индикатора ;
(Тв - Тi)oС - разность температур между кровью и индикатором ;
К - постоянная, зависящая от размера катетера, удельной теплоемкости индикатора, скорости его введения;
tв(t) - текущее значение температуры.
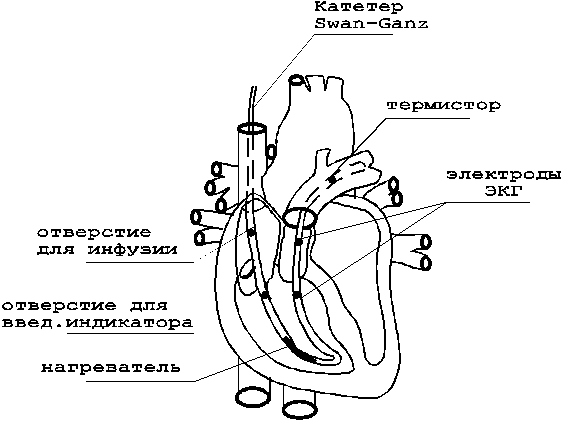
Рисунок 25 - Зондирование сердца катетером Swan-Ganz
Кривая разведения полученная методом термодилюции представляет собой зависимость температуры, регистрируемой термистором, от времени.
Погрешности метода термодилюции в основном связаны с методикой введения индикатора и его характеристиками. Ошибки уменьшаются с увеличением объема инъекции, но слабо зависят от увеличения разности температур между кровью и индикатором. Кроме того, при очень сильном охлаждении индикатора могут возникнуть сердечные аритмии.
Из-за малых погрешностей измерений метод термодилюции считается клиническим стандартом в определении сердечного выброса.
В настоящее время выпускается аппаратура, позволяющая вести мониторинг сердечного выброса методом термодилюции с вычислением различных гемодинамических показателей.
Система REF-1 (Вaxter, США) / 52 /, включающая катетер Swan - Ganz, позволяет контролировать гемодинамические параметры : минутный объем кровообращения, сердечный индекс, ударный объем, ЧСС по результатам оценки R-R интервалов внутрисердечной ЭКГ, а также фракцию выброса правого желудочка (долю крови, выбрасываемую за один удар), конечно-систолический и конечно-диастолический объемы правого желудочка. Прибор имеет графический дисплей для отображения кривой разведения и вычисляемых параметров.
Монитор сердечного выброса “Vigilance” (Baxter, США) позволяет вести непрерывные измерения показателей без инъекции индикатора. Для построения кривой разведения используется импульсное изменение температуры крови в правом предсердии с помощью спирального импульсного малоинерционного нагревателя, укрепленного на поверхности катетера Swan - Ganz в той его части, которая располагается в правом предсердии (рис.25). Поскольку тепловые импульсы, сообщаемые крови, имеют малую мощность, то в мониторе используется оригинальная система формирования время-импульсного кода нагрева и корреляционного обнаружения и измерения изменений температуры крови в легочной артерии, необходимая для точного построения кривой разведения. Данный монитор дает хорошее совпадение результатов измерений с традиционной методикой термодилюции и обладает рядом очевидных достоинств, главным из которых является отсутствие необходимости введения раствора индикатора.
Неинвазивная оценка величины сердечного выброса
Инвазивные средства измерения сердечного выброса, обеспечивая необходимую точность определения параметров центральной гемодинамики, применяются в случаях, когда риск, связанный с процедурами зондирования сердца, оправдан необходимостью получения диагностической информации. Это ограничивает широкое применение инвазивных средств в практике клинического мониторинга. Особенно это относится к методу термодилюции, требующему катетеризации легочной артерии.
В то же время развитие косвенных методов оценки параметров гемодинамики позволяет с достаточной точностью определить пульсовые изменения центрального и периферического кровотока, что в сочетании с компьютерными средствами обработки биологических сигналов открывает возможность построения технических средств для неинвазивной оценки величины сердечного выброса.
Ультразвуковой допплеровский (УЗД) метод оценки сердечного выброса основан на измерении скорости потока крови в грудной аорте с помощью УЗД датчика. Минутный объем кровообращения может быть определен по формуле
МОК = Vср S a Tи ЧСС,
где Vср, дм/с - скорость крови в аорте, усредненная за время изгнания;
S a, дм2 - площадь поперечного сечения аорты ;
Ти, с - время изгнания.
Необходимыми условиями проведения ультразвуковых допплеровских измерений является обеспечение перекрытия рабочим сектором УЗД датчика площади аорты и выбор такого положения датчика, при котором он бы находился в непосредственной близости к исследуемому потоку и ультразвуковые колебания распространялись бы в направлении потока крови.
Наиболее просто реализуется супрастенальное положение УЗД датчика. Оно позволяет измерить скорость потока крови восходящей части аорты. Для проведения измерения УЗД датчик периодически помещается в яремную ямку и излучение датчика направляется вдоль аорты. Для измерений могут быть использованы приборы с непрерывным или импульсным режимом излучения. Импульсный режим является более помехоустойчивым, так как он позволяет считывать информацию о скорости кровотока на определенном расстоянии от датчика, в области расположения интересующих анатомических структур.
Диаметр аорты, необходимый для вычисления МОК, может быть определен с помощью анализа прекардиального эхокардиографического изображения или найден по номограммам.
Сравнение результатов , полученных супрастенальным УЗД методом, с данными термодилюции показывает удовлетворительное соответствие (коэффициент корреляции r = 0,94; 0,87) в большом диапазоне значений МОК (1,86 ... 10,1 л/мин), однако авторы, использующие эту методику, отмечают важность правильного размещения датчика / 42 /.
При чреспищеводном измерении сердечного выброса УЗД датчик крепится к стандартному пищеводному стетоскопу и оценка кровотока осуществляется в нисходящей части аорты. Калибровка чреспищеводных измерений проводится с помощью супрастенального датчика, путем определения поправочного коэффициента, учитывающего изменение скорости кровотока в нисходящей части аорты. Однако при изменениях мозгового кровообращения такая калибровка может быть неточной.
Данный метод измерений считается относительно неинвазивным, так как большой размер датчика не позволяет проводить его использование без общей анестезии. Однако в кардиохирургии, когда необходимо постоянное наблюдение за величиной сердечного выброса, данный метод находит широкое применение.
Для внтуритрахеального измерения сердечного выброса используется специальная эндотрахеальная трубка, содержащая импульсный УЗД датчик. Ультразвуковые колебания излучаются датиком в направлении кровотока восходящей части аорты. Использование сканирующего датчика позволяет с его помощью определить диаметр аорты для вычисления величины сердечного выброса. Ограничением метода является необходимость интубации трахеи. Дополнительные ошибки возникают из-за движения трубки во время дыхания, однако они, как показывает сравнение с методом термодилюции, оказываются небольшими / 42 /.
Использование метода импедансной плетизмографии (реографии) для оценки величины сердечного выброса основано на анализе изменений электрического сопротивления грудной клетки под влиянием сосудистого кровотока.
Показано / 53 /, что при прохождении через ткани, содержащие артериальный сосуд, слабого переменного тока существует линейная зависимость между колебаниями электрического сопротивления тканей и пульсовыми колебаниями объема крови:
,
где ,
- относительное изменение сопротивления тканей между электродами,
, - относительное
изменение объема крови в тканях в той же области.
Исходя из этого соотношения, можно по измерениям электрического сопротивления тканей определить параметры кровотока.
Для проведения измерения выбирается слабый переменный ток амплитудой порядка 5-10 мА, частотой около 100 кГц, прикладываемый к тканям через накожные электроды. Зарегистрированные изменения сопротивления тканей определяются пульсацией крови в крупных сосудах и коррелируют с фазами сердечного цикла (рис.26).
W.Kubicek / 54 /, изучая торакальную импедансную плетизмограмму, регистрируемую с измерительных электродов расположенных на шее и грудной клетке на уровне мечевидного отростка, показал, что систолический объем пропорционален максимуму скорости изменения сопротивления тканей Z и продолжительности фазы изгнания Ти (рис.26).
Формула определения систолического объема имеет вид
СО =( p L2 / Zo2 ) Tи ( dz / dt )мах ,
где p - удельное сопротивление крови,
L - расстояние между электродами,
Zo - базовая величина сопротивления межэлектродного промежутка.
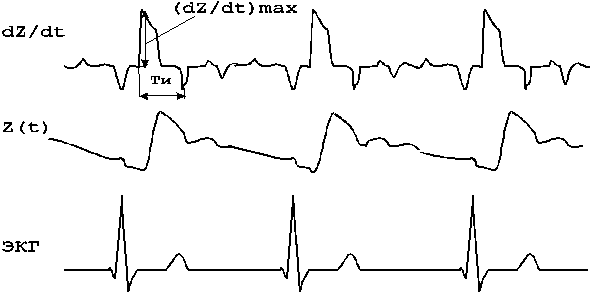
Рисунок 26 - Запись изменений торакального сопротивления и ЭКГ
Сравнение полученных значений сердечного выброса при торакальном расположении электродов с данными, определенными по методам A.Fick, разведения красителя и термодилюции, показало хорошее соответствие результатов ( r = 0,85). При оптимизации импедансного метода (использование активной составляющей спротивления, минимизация расстояния между электродами) соответствие еще более улучшается ( r = 0,94). Методика импедансной плетизмографии обладает высокой чувствительностью, что было показано на примере оценки изменений систолического объема во время проведения ортостатических проб / 55 /.
В мониторах сердечного выброса, построенных на импедансном методе, может быть использована стандартная реографическая методика регистрации зависимости изменения сопротивления тканей между измерительными электродами. Компьютерная обработка этой зависимости позволяет в реальном масштабе времени производить вычисление dz/dt, поиск максимума и минимума кривой необходимые для определения данных, входящих в выражение для СО (рис.26).
Наибольшие ошибки при обработке сигнала реограммы возникают при определении величины времени изгнания Ти, так как инцизура реограммы может быть слабо выражена. Для уменьшения погрешностей может использоваться модель реографического сигнала в экспоненциальном разложении / 56 /.
Для ослабления сетевых помех при регистрации реограммы и артефактов движения может быть использован параболический цифровой фильтр, а для идентификации характерных точек реограммы - первая и вторая производная реограммы / 57 /.
В многоканальных мониторах, содержащих канал ЭКГ, реографические электроды могут быть совмещены с электродами ЭКГ в первом стандартном отведении с развязкой через фильтры, настроенные на частоту тока реографических измерений / 58 /. Кроме того, присутствие ЭКГ сигнала позволяет повысить точность измерения Ти.
Другим, реографическим методом определения сердечного выброса является метод М.И.Тищенко -интегральная реография тела (ИРГТ) / 37 /. Метод можно рассматривать как электрическую модель метода ультранизкочастотной баллистокардиографии - одного из наиболее точных механических методов оценки параметров гемодинамики, используемых в функциональной диагностике.
Запись кривой ИРГТ напоминает по форме сфигмограмму, на которой легко выделяются анакротическая и катакротическая части. Для расчета СО необходимо определение характерных точек кривой, по которым находят расстояние между моментами начала фаз быстрого изгнания соседних комплексов (С), равное длительности сердечного цикла, длительность катакротической части реограммы (Д), максимальную амплитуду реограммы (у) (рис.27).
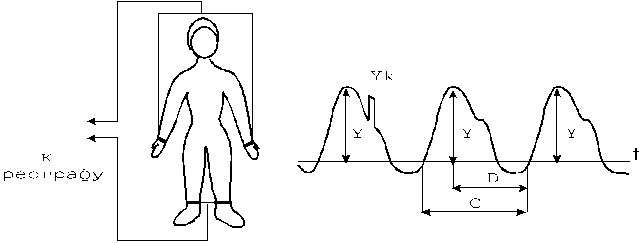
Рисунок 27 - Запись интегральной реограммы по методу М.И.Тищенко
Величина СО рассчитывается по формуле
СО = k l2 у С / yк Д R,
где k - поправочный коэффициент ( для мужчин - 0,275, для женщин - 0,247);
R- базовое сопротивление;
ук - амплитуда калибровочного сигнала;
l- рост обследуемого.
Благодаря дистальному расположению электродов помехоустойчивость метода ИРГТ выше, чем при торакальной импедансной плетизмографии, поэтому ИРГТ удобнее для применения в клинической анестезиологии и реаниматологии. Кроме того, в отличие от метода W. Кubichek, с помощью ИРГТ рассчитывается ряд ценных клинических показателей (коэффициент интегральной тоничности как показатель системного артериального тонуса, колебания ударного объема за дыхательный цикл, показатели взаимосвязи сердечно-сосудистой и дыхательной систем, соотношения вне- и внутрисосудистой жидкости и др.)
Использование тетраполярного варианта ИРГТ и применение дифференциальной ИРГТ позволяет использовать для расчета ударного объема формулу W.Kudichek/ 59 /.
Достоинством импедансных мониторов является непрерывное измерение и индикация текущих значений сердечного выброса, позволяющие быстро оценить изменение состояния сердечно-сосудистой системы пациента.
Для определения величины сердечного выброса может быть использован компьютерный анализ фотоплетизмограммы, регистрируемой пульсоксиметрическим датчиком на мочке уха.
Для 42 реанимационных больных получено хорошее соответствие результатов измерения СО с данными определенными методом термодилюции (r =0,93, максимальное отклонение - не более 10%) / 60 /. Метод является перспективным из-за простоты процедур измерения и возможности непрерывного мониторинга сердечного выброса, хотя остается неясной проблема калибровки результатов измерения СО при различных формах патологии периферического кровообращения.
Так как сердечный выброс во многом определяет величину артериального давления, то рядом исследователей были предложены формулы для вычисления СО с учетом измеренных прямым или косвенным методами показателей АД / 37 /.
Точность вычисления СО недостаточна, однако недостатки определения абсолютной величины СО компенсируются возможностью производить эти исследования в динамике.
Формула Бремзера-Ранке :
СО = 1332 D Р Z S Т Q / Ср Д,
где Q,см2 - площадь поперечного сечения аорты, определяемая
по таблице или номограмме,
DР, мм рт.ст. - пульсовое давление,
Z - фактор поправки, равный 0,6 для человека;
(S, D, Т), с, - соответственно длительность систолы, диастолы и сердечного
цикла,
Ср, см/с - скорость распространения пульсовой волны по аорте.
Формула Старра :
СО = 90,97 +0,54 DР – 0,57Рd – 0,61В,
где Рd, мм рт.ст - диастолическое давление,
В- возраст, в годах.
Для определения СО у детей была предложена следующая формула:
СО = 80 + 0,5 DР – 0,6 Рd – 2В
Методики оценки сократительной деятельности сердца по проявлениям его механической активности (баллистокардиография, апекскардиография, динамо- и кинетокардиография) оказались малопригодными для мониторинга показателей центральной гемодинамики, основное их применение - использование в функциональной диагностике сердечно-сосудистой системы.
Наряду с мониторингом параметров АД, СО, ЦВД, важное значение в клинической практике имеет слежение за некоторыми производными этих величин.
Предел нормальных значений МОК у взрослого человека в норме составляет 3,5 - 5,5 л/мин, при физической нагрузке - 25 - 30 л/мин. МОК увеличивается при различных стрессовых ситуациях за счет выброса катехоламинов. Даже при гиповолемии, благодаря компенсаторной тахикардии, МОК может поддерживаться на должном уровне, но при этом страдает периферическое кровообращение. МОК уменьшается при декомпенсированной гиповолемии, выраженной сердечной слабости, шоке, резкой сосудистой недостаточности.
Отношение МОК к поверхности тела Sт является относительно постоянной величиной и называется сердечным индексом (СИ):
СИ[ л/мин/м2] = МОК / Sт.
Соответственно, отношение СО к Sт называется ударным индексом (УИ) :
УИ[ мл/м2] = СО / Sт.
Поверхность тела Sт (в м2) можно определить по формуле Брейтмана:
Sт[м2 ] = 0,0087 (l+М) – 0,26,
где l- рост в см,
М- масса в кг.
Величину Sт можно определить, также, по нормограмме Герцога-Энгстрема или Дюбуа.
Общее периферическое сосудистое сопротивление (ОПСС) представляет собой суммарное сопротивление системы артериол - величину, обратную суммарной проходимости артериол. ОПСС может быть найдено по формуле Пуазейля
ОПСС [ дин с/ см– 5 ] = 79920Рm / МОК ,
где Рm - среднее динамическое давление.
Предел нормальных колебаний ОПСС - 1200- 2500 дин с/см– 5 .
ОПСС увеличивается при компенсированной кровопотере, инфаркте миокарда, поверхностном наркозе, гипертонической болезни и уменьшается при коллапсе, декомпенсированной кровопотере, глубоком наркозе, септическом шоке, интоксикации.
Отношение ОПСС к поверхности тела Sт называется удельным периферическим сопротивлением (УПСС), которое отражает состояние наиболее периферических отделов артериального русла (прекапилляров).
Клиническое значение мониторинга параметров давления крови, сердечного выброса и их производных
Роль величины АД в периферических сосудах в клинической практике общеизвестна. Высота АД зависит, главным образом, от изменения сердечного объема, объема циркулирующей крови (ОЦК), периферического сопротивления (ОПСС), причем вклад каждого из перечисленных факторов в поддержании АД примерно одинаков.
Самым динамичным гемодинамическим показателем является периферическое сопротивление. Если изменяется один фактор (например, снижается ОЦК за счет кровопотери), то АД способно поддерживаться за счет компенсаторных изменений других факторов (увеличение сердечного выброса, рост ОПСС). Если же изменяются два фактора (например, снижаются ОЦК и МОК), то поддержание адекватного АД резко затрудняется и это ухудшает прогноз.
Таким образом, для выбора правильной тактики лечения необходимо иметь представление о том, какие механизмы поддержания АД подвержены изменениям первично, а сдвиг каких является компенсаторным. Поэтому наряду с клинической оценкой состояния больного очень важное значение в клинической анестезиологии и реаниматологии имеет определение СО, МОК, ОПСС, СИ. Не касаясь клинических вопросов диагностики и лечения, рассмотрим основные формы изменения АД.
Среди острых артериальных гипотензий в зависимости от первопричины выделяют три типа; сердечный тип, сосудистый (коллапс) и гиповолемический.
1. Сердечные гипотензии могут возникнуть вследствие инфаркта миокарда, сердечной астмы, декомпенсации функций сердца, токсических и других повреждений миокарда. Гемодинамические изменения: снижается преимущественно АД, уменьшается пульсовое АД, СО снижен; МОК нормальный или снижен, ОПСС повышено, ЦВД повышено.
2. Сосудистые гипотензии (коллапс). Причиной может послужить глубокий наркоз, высокая спинно-мозговая или перидуральная анестезия, острые отравления снотворными, анестезиологическими и адренолитическими средствами, ганглиоблокаторами, надпочечниковая недостаточность, септический шок. Снижается преимущественно диастолическое АД и в меньшей степени систолическое, поэтому пульсовое давление увеличено. СО вначале увеличен (при легкой гипотензии), в дальнейшем нормальный или снижен (при резкой гипотензии), МОК увеличен, нормальный или снижен (если гипотензия резка); ОПСС снижено; ЦВД нормальное или снижено.
3. Гиповолемические гипотензии ( вследствие кровопотери). В начале умеренной кровопотери (до 10% ОЦК) эффект перераспределения (централизации) кровотока выражается нормальным или слегка повышенным систолическим АД вследствие поддержания венозного притока (преднагрузки правого желудочка) за счет повышения тонуса периферических вен. СО, МОК и ОПСС нормальные или слегка повышены.
При большой кровопотере механизмы компенсации оказываются недостаточными для обеспечения достаточного притока крови к сердцу. Поэтому снижаются систолическое АД, СО; диастолическое АД остается более высоким, чем в норме, нормальным или несколько снижается; ОПСС повышается.
В дальнейшем при истощении механизмов централизации кровообращения еще больше снижается приток крови к сердцу, вторично снижается систолический объем, снижается АД. Систолическое АД снижается более существенно, чем диастолическое АД, поэтому уменьшается пульсовое АД; снижается ЦВД.
Очень важно, приступая к лечению, оценить, имеет ли место гиповолемия. Одним из объективных критериев этого является конечный диастолический объем (КДО) желудочка определяемый методом эхокардиографии.
Известно, что величина ударного объема во многом определяется КДО. Оставшийся после систолы в желудочках объем крови называется конечно-систолическим объемом (КСО). Очевидно, что
СО = КДО – КСО.
ЦВД при серьезной гиповолемии не может достаточно объективно характеризовать степень гиповолемии.
Любая терапия должна быть направлена на увеличение сердечного выброса при минимальной работе сердца. При этом работа сердца по перекачке малого систолического объема против высокого давления значительно выше, чем работа по перекачке большого систолического объема против нормального давления, т.е. работа сердца как “генератора потока” меньше работы сердца как “генератора давления”. Поэтому при всех видах острого нарушения кровообращения, которое сопровождается повышением периферического сопротивления сосудов, сердечный насос работает в режиме “генератора давления”.
Основная задача лечения - перевести работу сердца в режим “генератора потока”.
Для достижения этой цели необходимо иметь точный гемодинамический портрет пациента, что в критических состояниях достигается только катетеризацией центральной вены и полостей сердца.
Гемодинамические нарушения можно объединить в пять основных гемодинамических типов нарушений, которые могут переходить из одного в другой, каждому из которых соответствует свой вариант лечения / 61 / :
Тип 1. Эукинетический.
Признаки: ДЗЛК от 6 до 15 мм рт.ст. СИ от 2,5 -4,5 л/мин/м2.
Терапия: инфузия норадреналина с одновременным жидкостным обеспечением.
Тип 2. Гипокинетический.
Признаки: ДЗЛК > 20 мм рт.ст. СИ < 2,5 л/мин/ м2, АД средн. <90 мм рт.ст. Часто встречается при кардиогенном шоке. Смертность около 80%.
Терапия: сочетание добутамина со средними дозами доламина и/или нерадреналина.
Тип 3. Застойный
а) без артериальной гипотензии.
Признаки : ДЗЛК > 18 мм рт.ст. АД ср > 110 мм рт.ст. СИ > 2,5 или < 2,5 л/мин/ м2
Терапия: вазодилятаторы (нитроглицерин, нитропрусенд, аденозин), диуретики. В случае снижения АД и/или СИ добавить добутамина.
б) с артериальной гипотензией.
Признаки те же, но АД ср. < 80 мм рт.ст.
Терапия: инотропная поддержка комбинацией адреномиметиков. В случае выраженной вазодилятации - норадреналин, при вазоконстрикции - после стабилизации Ад ср. добавить инфузию нитроглицерина.
Тип 4. Гиповолемический.
Признаки : ДЗЛК < 15 мм рт.ст., АД ср < 90 мм рт.ст. КДО < 120 мл.
Терапия : восполнения ОЦК
Тип 5. Гипердинамический.
Признаки : ДЗЛК <15 мм рт.ст. СИ > 4,5 л/мин/ м2, КДО > 120 мл.
Терапия: постоянная инфузия бетта -блокаторов.
Наконец, при лечении гипертензивных состояний в настоящее время важно оценить, за счет каких механизмов поддерживается повышенное артериальное давление. В этой ситуации большую пользу приносят неинвазивные методы определения сердечного выброса и расчет производных показателей.
Если первопричиной гипертензии служит увеличенный ОЦК, то обычно используют мочегонные средства и препараты, увеличивающие емкость сосудистого русла (ганглоблокаторы, ингибиторы ангиотензин - конвертирующего фермента).
Если гипертензия возникает за счет преимущественно увеличения систолического объема, то используют адреноблокаторы, ингибиторы кальция.
Если гипертензия является результатом усиления ОПСС, то решается вопрос о введении спазмолитических препаратов и необходимости компенсации гиповолемии.
Так как указанные факторы могут изменяться в процессе лечения, то очень
важно вести неинвазивный мониторинг показателей кровообращения для своевременной
коррекции терапии.